Микоплазменная инфекция
����: 2009/8/11 | ������: Здоровье женщины
А.А. Хрянин
Новосибирский государственный медицинский университет
Резюме. В связи с наблюдающимся в последние годы резким прогрессом в расшифровке механизмов взаимодействий микробиоценозов различных экосистем с организмом человека и в понимании значимости симбиотической нормофлоры в поддержании репродуктивного здоровья, современные пробиотики на основе физиологической микрофлоры, в частности высококонцентрированный отечественный мультипробиотик Симбитер-2 с широким спектром биологических свойств, должны все шире внедряться в акушерско-гинекологическую практику. Приводятся описание Симбитера-2 и результаты исследования его клинической эффективности при лечении 146 больных бактериальным вагинозом. Адекватное дополнение комплексного лечения больных бактериальным вагинозом пробиотическим воздействием с помощью Симбитера-2 на нарушенную микрофлору влагалища и кишечника, являющихся наиболее важными и тесно взаимодействующими локусами микроэкологической системы женского организма, позволяет значительно повысить эффективность терапии и снизить частоту развития побочных эффектов и рецидивов болезни.
Резюме. У зв'язку з різким прогресом у розшифруванні механізмів взаємодій мікробіоценозів різних екосистем з організмом людини, що спостерігається в останні роки, та у розумінні значимості симбіотичної нормофлори у підтриманні репродуктивного здоров'я, сучасні пробіотики на основі фізіологічної мікрофлори, зокрема висококонцентрований вітчизняний мультипробіотик Симбітер-2 з широким спектром біологічних властивостей, повинні все ширше впроваджуватися в акушерсько-гінекологічну практику. Наводяться опис Симбітера-2 та результати дослідження його клінічної ефективності при лікуванні 146 хворих бактеріальним вагінозом. Адекватне доповнення комплексного лікування хворих бактеріальним вагінозом пробіотичним впливом за допомогою Симбітера-2 на порушену мікрофлору піхви та кишечника, які є найважливішими та тісно взаємодіючими локусами мікроекологічної системи жіночого організму, дозволяє значно підвищити ефективність терапії та знизити частоту розвитку побічних ефектів і рецидивів хвороби.
Summary. A steep progress in the decoding of mechanisms of interaction between microbiocenoses of various ecosystems and the human body and growing understanding of the importance of symbiotic normal flora for the upkeep of human reproductive health have prompted a recognition of the need for a wider introduction o modern physiological microflora
based probiotics (specifically, the highly concentrated domestic Symbiter-2 multiprobiotic with a wide spectrum of biological characteristics) into practical obstetrics and gynaecology. A description of Symbiter-2 and outputs of its clinical efficiency studies carried out in 146 patients with bacterial vaginosis are presented. Adequate supplementing of the complex therapy scheme applied to patients with bacterial vaginosis
with probiotic effect of Symbiter-2 on disturbed vaginal and intestinal microflora (known to be the most important and interlocked loci of the femail microecological system) allows considerably increasing the scheme efficiency while, in the same time, lowering the frequency of side effects and disease relapses.
Лабораторная диагностика
Отсутствие четких морфологических характеристик, а также полиморфизм, присущий всему семейству микоплазм, исключает возможность идентификации возбудителя в мазках от больных, поэтому цитологический метод не используется.
Для выявления микоплазменной инфекции применимы количественный (культуральный метод на плотных и жидких питательных средах) и полуколичественный (бесприборный культуральный метод) и качественный (полимеразная цепная реакция), методы лабораторной диагностики.
Культуральный метод — посев из уретры и влагалища на специальные элективные питательные среды для микоплазм, содержащие сыворотку лошади и дрожжевой экстракт, а для U. urealyticum — и мочевину. Культуральная диагностика с использованием жидких питательных сред относится к количественным методам. «Цветная реакция» основана на расщеплении мочевины, необходимой для роста U. urealyticum, изменении рН и, как следствие, изменении цвета среды, в которую добавлен индикатор. При этом положительным считается только такой результат, когда из первой пробирки производилась рекультивация в свежую порцию среды, и в ней также
Если во втором пассаже (вторая пробирка) изменение цвета не наблюдалось, результат расценивается как подозрительный, что требует повторного взятия материала.
Подозрительный результат в первом исследовании может быть обусловлен либо небольшим количеством уреаплазм, либо наличием слабых штаммов, что необходимо исключить, повторив процедуру взятия материала.
В том случае, когда при повторном исследовании наблюдалась та же картина (изменение цвета в первой пробирке и отсутствие цвета во второй пробирке), результат оценивается как отрицательный. В ходе диагностики могут выявляться и ложноположительные результаты, когда в первые 5 ч после взятия материала от женщин наблюдается изменение цвета в пробирке. Такой результат требует
повторного исследования [3, 4].
Бактериологический метод («цветная реакция») позволяет определить в образцах, как правило, жизнеспособные формы, которые, размножаясь и утилизируя мочевину, изменяют цвет среды. Культивирование в жидкой среде является наиболее чувствительным методом, позволяющим осуществлять количественную оценку наличия микроорганизмов в исследуемом материале.
На плотных питательных средах колонии U. urealyticum выглядят в виде неправильных кольцевидных фигур с плотным врастающим в агар центром и нежной поверхностной периферией (по типу яичницы-глазуньи). Поверхность их гранулярная, края зубчатые, цвет коричневый (или желтый), размеры варьируют от 30–50 до 100 мкм. Именно культуральный метод на плотных питательных средах позволяет подсчитать количество колоний и тем самым точно определить массивность колонизации этих микроорганизмов (рис. 1, 2).


К современным полуколичественным методам лабораторной диагностики относятся — бесприборные культуральные тесты. Современные диагностические компании «биоМерье» («bioMerieux», Франция) и «БИО-РАД» («BIO-RAD», Франция) выпускают бесприборные коммерческие тест-системы для выявления микоплазменной инфекции, которые позволяют сократить рутинную процедуру, отказаться от чистой культуры и совместить полуколичественную оценку и идентификацию.
Для постановки этих тестов не требуется дополнительного оборудования и оснащения микробиологической лаборатории. Все необходимое для постановки теста включено в набор. Чтение и интерпретация результатов осуществляется визуально по изменению цвета в лунках через 24–48 ч.
Этапы микробиологического исследования с помощью стандартизованного диагностического набора «Микоплазма ДУО» (БИО-РАД, Франция) указаны на рисунке 3.

Подобные коммерческие тест-системы могут быть использованы для рутинных исследований благодаря следующим преимуществам: процедура инокуляции микропланшета очень проста и высоко стандартизована; культивирование урогенитальных микоплазм осуществляется в жидкой среде, что снижает вероятность процесса аутолиза микроорганизмов; количество бактерий (КОЕ/мл) определяется методом последовательных разведений; М. hominis и U. urealiticum дифференцируются по способности метаболизировать аргинин и мочевину соответственно; результаты регистрируются визуально (наличие цветового индикатора роста в питательной среде) [10].
Для определения чувствительности к антибактериальным препаратам используются тест-системы — «Микоплазма СИР» (БИО-РАД, Франция), «Микоплазма ИСТ 2» (биоМерье, Франция). В набор входит микропланшет, в лунках которого в дегидратированном виде находятся в двух концентрациях следующие антибиотики: доксициклин, миноциклин, тетрациклин (4 и 8 мг/л), джозамицин (2 и 8 мг/л), эритрамицин, офлоксацин (1 и 4 мг/л). Клиндамицин и пристинамицин содержатся в одной активной концентрации (2 мг/л). Они растворяются при добавлении стандартизованного инокулята. Концентрации антибиотиков подобраны так, чтобы профиль чувствительности штамма определялся как: чувствительный, устойчивый или умеренно-устойчивый. Определение роста также происходит по изменению цвета в присутствии индикатора.
Использование коммерческих тест-систем дает возможность в рутинных исследованиях сократить, упростить и стандартизовать процедуру, совмещая этапы анализа и избегая ошибок выполнения протокола. Цветовая индикация позволяет объективно оценить результат лабораторного исследования.
Серологические методы не имеют диагностической значимости из-за низкой специфичности, так как нельзя исключить межвидовые перекрестные реакции (между М. hominis, U. urealyticum, M. genitalium и другими микоплазмами).
Серологические методы могут быть использованы, но только как дополнительные (вспомогательные), требующие обязательного подтверждения (при положительном результате) культуральным и/или молекулярно-биологическим методами.
Молекулярно-биологический метод. Появление специфических методов амплификации ДНК, в частности ПЦР, открыли новые возможности для диагностики внутриклеточных инфекций. ПЦР основана на выделении ДНК из исследуемого материала и распознавании последовательности нуклеотидов в генах микоплазм. ПЦР представляет собой многократно повторяющиеся циклы синтеза (амплификации) специфической области ДНК-мишени. ПЦР относится к качественным методам лабораторной диагностики микоплазменной инфекции. Чувствительность и специфичность метода ПЦР приближается к теоретически возможным и составляет 96% и 98% соответственно. Методика ПЦР позволяет достаточно быстро получить результаты анализов. ПЦР является наиболее доступным и единственным методом выявления М. genitalium, так как культуральный метод не используются из-за трудности получения в чистой культуре (рост на питательных средах составляет от 1 до 5 мес.).
Широкое распространение ПЦР, несомненно, позитивный признак, как внедрение любой современной технологии. Однако следует отметить, что наблюдается целый ряд отрицательных моментов, отражающихся как на качестве лабораторной диагностики, так и на репутации самого метода.
Поскольку метод относительно новый, то имеются погрешности, связанные с внедрением ПЦР в клиническую и научную практику: полностью не отработана организация работы ПЦР-лабораторий, недостаточная квалификация персонала и отсутствие диалога между лабораторией и лечащим врачом приводят к ложным результатам и ошибочным диагнозами.
При несоблюдении территориальных нормативных условий (необходимо наличие не менее 3-х стерильных зон и т.д.) при размещении ПЦР-лабораторий возникает контаминация проб и как следствие этого, возникают ложноположительные результаты (рис. 4).

В настоящее время методы диагностики ИППП не достаточно объективны и не позволяют врачу четко представлять реальную ситуацию, а значит правильно поставить диагноз.
Достаточно остановиться на типовом бланке ПЦР-лаборатории ИППП, который используется во многих медицинских учреждениях страны (табл. 1).

Если результаты методом ПЦР оказываются положительными, то всегда ли врач имеет право поставить диагноз в зависимости от выявленного возбудителя или нет?
Да, если это патогены, такие как С. trachomatis, M. genitalium, вирус папилломы человека. Что же касается бактериальных резидентов — U. urealyticum. M. hominis, G. vaginalis С. albicans, то именно они создают определенные трудности в интерпретации лабораторных результатов и зачастую, к сожалению, имеют широкую спекулятивную славу среди практикующих врачей.
Кроме того, метод ПЦР, в настоящее время, не включен в действующие регламентирующие документы, в связи с чем, диагноз урогенитального трихомониаза, гонореи и сифилиса, установленный с его помощью, не будет считаться юридически правомочным. Однако ПЦР может использоваться в качестве вспомогательного метода в выявлении трихомонадной и гонококковой инфекций.
При этом отрицательный его результат не учитывается, а положительный носит рекомендательный характер и требует дополнительного обследования регламентирующими методами.
Необходимо лечить не сомнительные результаты лабораторных анализов, а только больного человека при выявлении у него действительно абсолютных патогенных микроорганизмов — достоверными и регламентирующими методами лабораторной диагностики ИППП.
В заключении, важно напомнить, что лабораторная диагностика начинается в момент взятия клинического материала и поэтому правильный забор материала определяет надежность любого диагностического метода.
Лечение микоплазменной инфекции
Лечение микоплазменной инфекции (М. hominis, U. urealyticum) назначается при определенных условиях, если имеется: клинические проявления воспалительных процессов; бесплодие; отягощенный акушерско-гинекологический анамнез. Когда кроме микоплазменной инфекции других причин этих состояний не установлено и величина титра микоплазм в выделенной культуре соответствует пороговой концентрации возбудителя — 104 КОЕ/мл. Кроме того, рекомендуется лечение при выявлении наиболее патогенной из существующих микоплазм — М. genitalium.
Важно отметить, что фторхинолоны имеют лишь умеренную активность против М. genitalium in vitro по сравнению с макролидами, а азитромицин (Сумамед), по меньшей мере, в 100 раз более активен in vitro против М. genitalium в сравнении с каким-либо из фторхинолонов или тетрациклинов.
Поскольку в настоящее время протоколы ведения (стандарты лечения) больных с выявленной микоплазменной инфекцией официально отсутствуют, то каков должен быть выбор антибиотикотерапии?
В этиотропном лечении микоплазменной инфекции урогенитального тракта используются антибактериальные препараты, подавляющие биосинтез белка и ДНК.
Это, в первую очередь, препараты из группы тетрациклинов и макролидов. Активность любого антибактериального агента в отношении микоплазменной инфекции определяется минимальной подавляющей концентрацией (МПК) в исследованиях in vitro.
Показатели МПК являются прогностически значимыми и могут свидетельствовать о корреляции лабораторных данных с клиническим излечением [11]. Чем меньше показатель МПК, тем выше активность антибактериального агента и, следовательно, чувствительность к нему возбудителя (табл. 2).
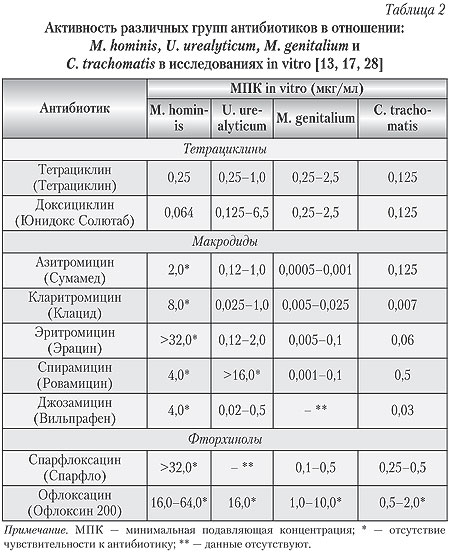
Из представленной таблицы видно, что наибольшей активностью в отношении U. urealyticum обладают — кларитромицин, джозамицин и доксициклин. Определенные трудности в лечении представляет М. hominis, которая имеет чувствительность, в основном, только к тетрациклину и доксициклину. Азитромицин обладает оптимальным спектром активности в отношении внутриклеточных бактериальных агентов.
Интересным фактом является то, что и спектр чувствительности к антибиотикам у М. genitalium такой же, как и у хламидийной инфекции (табл. 2).
Исследования эффективности различных антибиотиков в отношении М. genitalium единичны и проводились на небольшом количестве обследованных (10–20 человек) [25, 44]. Поэтому до настоящего времени вопрос лечения этой инфекции остается малоизученным и актуальным.
По данным D. Taylor-Robinson и соавт. (2004), 11 инфицированных М. genitalium мужчин с негонококковым уретритом в течение 4–6 недель принимали эритромицин в дневной дозе 500 мг. В результате лечения отмечалось клиническое и микробиологическое выздоровление у 9 (82,0%) пациентов, однако в дальнейшем клиника появилась вновь у шести из них без выявления М. genitalium.
В сравнительном исследовании эффективности тетрациклина и азитромицина в лечении М. genitalium оказалось, что тетрациклин был эффективен лишь у 29,0% женщин и 37,0% мужчин, в то время, как ни у одного из 16 мужчин и 20 женщин, получавших терапию азитромицином, М. genitalium не была выявлена через месяц после лечения [25].
Результаты других современных исследований указывают на высокую активность (85,0%–96,0%) азитромицина (Сумамеда) в отношении М. genitalium при однократном применении в дозе 1 г [7, 18, 19, 33, 35].
Однократное применение азитромицина (Сумаме да) в дозе 1 г является наиболее эффективным и рациональным средством лечения М. genitalium.
Эффективность лечения напрямую зависит от того, какой препарат используется — оригинальный или его воспроизведенная копия (генерик). Например, из макролидов наибольшее количество генериков зарегистрированных в России отмечено у азитромицина («Сумамед», Плива, Хорватия): «Азивок» (Индия); «Азитрокс» (Россия); «Азитромицин-Акос» (Россия); «Азитромицин» (Грузия); «Зимакс» (Бангладеш); «Зифактор» (Веро Фарм, Россия); «Зитролид» (Щелковский витаминный завод, Россия); «Сумамецин» (Оболенск, Россия); «Сумамокс» (Индия); «Хемомицин» (Хемофарм, Югославия) и другие.
Без сомнения, самым приятным в воспроизводимых копиях является их стоимость. Обычно она составляет 40-80% от цены оригинального препарата. Но не стоит забывать, что в экономике чудес не бывает, и общая более низкая стоимость генерика складывается, в том числе, и за счет снижения себестоимости активных субстанций (нередко используется низкосортное лекарственное сырье), вспомогательных веществ (изменение в составе которых, могут привести к ухудшению биодоступности препарата в целом и вызывать токсические явления) и упаковочных материалов [37].
При выборе лекарственного препарата важно располагать фактическими данными о терапевтической равноценности препаратов. В случае выбора генерика это весьма проблематично, так как в большинстве случаев неизвестно, насколько объективна информация, на основании которой врач может принимать решение о замене одного аналога другим без ущерба для пациента [9].
Перенос результатов клинических исследований, полученных на оригинальных препаратах, на их воспроизводимые копии — некорректен и недопустим. Необходим взвешенный подход к результатам малочисленных исследований генериков, с учетом отдаленных последствий. Только качество производства лекарственного средства может определять эффективность лечения.
Перенос результатов клинических исследований, полученных на оригинальных препаратах, на их воспроизводимые копии — некорректен и недопустим. Необходим взвешенный подход к результатам малочисленных исследований генериков, с учетом отдаленных последствий. Только качество производства лекарственного средства может определять эффективность лечения.
Основные преимущества и недостатки применения различных групп антибиотиков (тетрациклины, макролиды, фторхинолоны) в венерологии представлены в табл. 3.

Прежде чем назначить этиотропное лечение, необходимо исключить другие возможные инфекции, передаваемые половым путем, а при их наличии использовать рациональную терапию.
Не обосновано назначение длительных или повторных курсов антибиотиков пациентам без клинических проявлений воспалительного процесса, только на основании обнаружения микоплазменной инфекции. Вызывает сомнение целесообразность применения иммуностимуляторов без выявленных иммунологических нарушений, а так же местного лечения микоплазменной инфекции.
К настоящему времени опубликовано большое количество результатов клинических исследований, часть из которых соответствуют принципам доказательной медицины. Однако пока преждевременно говорить, что неспецифическая терапия ИППП оправдала все возложенные на нее ожидания.
Следует особо подчеркнуть тот факт, что очень часто неспецифическая терапия ИППП (иммуномодуляторы общего действия, интерфероны и индукторы интерферонов) применяется бесконтрольно, без оценки иммунного статуса пациента и учета противопоказаний. Все это приводит с одной стороны к частичной дискредитации данного метода, а с другой стороны провоцирует развитие серьезных побочных эффектов. В качестве примера можно привести факт роста заболеваемости урогенными реактивными артритами, что в том числе связывают с бесконтрольным использованием интерферонов и интерфероногенов при лечении ИППП.
Таким образом, при лечении ИППП необходимо назначать лекарственные средства прямого действия (на возбудители заболевания), эффективность которых имеют доказательную базу, а также постараться минимизировать объем проводимой терапии ИППП.
ЛИТЕРАТУРА
1. Асцатурова О.Р., Остроумов О.А., Гурская Т.Ю., Никонов А.П. Сравнительная эффективность азитромицина и эритромицина в терапии урогенитального хламидиоза в третьем триместре беременности // Инфекционные заболевания. Гинекология. — 2001. — Т. 3, № 1. — С. 25—26.
2. Борисенко К.К., Тоскин И.А., Кисина В.И. О значении колонизации мочеполовых органов Mycoplasma hominis и Ureaplasma urealyticum // Инфекции, передаваемые половым путем. — 1999. — № 3. — С. 28—32.
3. Гладкова Н.С., Киселев В.И., Дарижапова Б.Д., Латыпова М.Ф., Дмитриев Г.А., Ушакова Н.И. Оценка различных методов лабораторной диагностики урогенитальных микоплазм // Вестн. дерматол. и венерол. — 1999. — № 2. — С. 43—45.
4. Делекторский В.В., Джалагания И.Д. Культуральная диагностика Ureaplasma urealiticum при воспалительных заболеваниях мочеполового тракта // Вестн. дерматол. и венерол. — 1984. — № 5. — С. 24—28.
5. Карамова А.Э., Поляков А.В., Хамаганова И.В. Значение Ureaplasma urealyticum и Mycoplasma genitalium как возбудителей воспалительных заболеваний урогенитального тракта // Клин. микробиол. и антимикробная химиотерапия. — 2004. — Т. 6, № 4. — С. 365—370.
6. Киселев В.И., Латыпова М.Ф., Дмитриев Г.А. Опыт работы лаборатории полимеразной цепной реакции ЦНИКВИ МЗ РФ. Проблемы и перспективы. Новое в диагностике и лечении заболеваний, передающихся половым путем и болезней кожи: Тезисы докладов. — М., 1997. — С. 167—168.
7. Кисина В.И., Ширшова Е.В., Ильина Е.И. Характеристика клинических синдромов, ассоциированных с М. genitalium, у пациентов с заболеваниями урогенитальной системы // Клин. дерматол. и венерол. — 2005. — № 3. — С. 33—38.
8. Лыкова С.Г., Хрянин А.А. Генитальные микоплазмы человека. — Новосибирск, 1999. — 34 с.
9. Лыкова С.Г., Хрянин А.А., Петренко О.С. Выбор антимикотика: бренд или генерик? // Рос. ж. кожных и венерических болезней. — 2005. — № 2. — С. 39—42.
10. Маликов В.Е., Гиммельфарб Е.И., Голубева Т.Н., Газизулин Р.Ю., Колмогорова И. В., Курдина М.И., Колупаев В.Е. Урогенитальный микоплазмоз: эффект стандартизации методов культуральной диагностики // Вестн. последипл. мед. образования. — 2005. — № 1. — С. 43—49.
11. Навашин С.М., Навашин П.С. Фармакокинетические показатели антибиотиков и их значение при разработке схем антибактериальной терапии, прогнозе эффективности // Антибиотики и химиотерапия. — 1993. — Т. 38 (10—11). — С. 30—31.
12. Овчинников Н.М., Беднова В.Н., Делекторский В.В. Лабораторная диагностика заболеваний, передающихся половым путем. — М., 1987. — 302 с.
13. Падейская Е.Н., Яковлев В.П. Антибактериальные препараты группы фторхинолонов в клинической практике. — М., 1998. — 351 с.
14. Прозоровский С.В. Микоплазмозы / Руководство по эпидемиологии инфекционный болезней. — Под ред. В.И. Покровского. — М., 1993. — С. 345—357.
15. Прозоровский С.В., Раковская И.В., Вульфович Ю.В. Медицинская микоплазмология. — М., 1995. — 286 с.
16. Раковская И.В., Вульфович Ю.В. Микоплазменные инфекции урогенитального тракта. — М., 1995. — 66 с.
17. Страчунский Л.С., Козлов С.Н. Макролиды в современной клинической практике. — Смоленск, 1998. — 302 с.
18. Хрянин А.А. Mycoplasma genitalium: современное состояние проблемы / Рациональная фармакотерапия в урологии: Руководство для практикующих врачей. — М.: Изд. дом »Литтерра», 2005. — Т. 10. — С. 63—66.
19. Хрянин А.А., Решетников О.В. Частота выявления Mycoplasma genitalium у мужчин и эффективность однократного приема сумамеда (азитромицина) в лечении микоплазменной инфекции // Клин. дерматол. и венерол. — 2005. — № 4. — С. 115—119.
20. Bjornelius E., Lidrink P., Jensen S.J. Mycoplasma genitalium in non-gonococcal urethritis — a study in Swedish male STD patients // Int. J. STD AIDS. — 2000. — V. 11. — P. 292—296.
21. Bonissol C.H. Isolement et identification des mycoplasmes urogenitaux // Med/ Mal. Infect. — 1980. — V. 10. — P. 640—646.
22. Bottone E., Stamm J. Schneierson's atlas of diagnostic microbiology (Ninth edition). Published by Abbott Laboratories. — 1984. — P.42—43.
23. Corradi G., Molnar G., Panovics J., Lindeisz F. Significant bacteriospermia. Value and limits of sperm count in Andrology // Orv. Hetil. — 1992. — V. 133 (43). — P. 2759—2762.
24. Dupin N., Bijaoui G., Schwarzinger M. et al. Detection and quantification of Mycoplasma genitalium in male patients with urethritis // Clin. Infect. Dis. — 2003. — V. 37. — P. 602—605.
25. Falk L., Fredlund H., Jensen J.S. Tetracycline treatment does not eradicate Mycoplasma genitalium // Sex Transm. Infect. — 2003. — V. 79. — P. 318—319.
26. Falk L., Fredlund H., Jensen J.S. Signs and symptoms of urethritis and cervicitis among women with or without Mycoplasma genitalium or Chlamydia trachomatis infection // Sex Transm. Infect. — 2005. — V. 81. — P. 73—78.
27. Gambiani D., Decleva I., Lupica L., Ghislanzoni M., Cusini M., Alessi E. Mycoplasma genitalium in males with nongonococcal urethritis // Sex Transm. Dis. — 2000. — V. 27. — P. 226—229.
28. Hannan P. Comparative susceptibilities of various AIDS-associated and human urogenital tract mucoplasmas and strains of Mycoplasma pneumoniae to 10 classes of antimicrobial agent in vitro // J. Med. Microbiol. — 1998. — V. 47. — P. 1115—1122.
29. Ishihara S., Yasuda M., Ito S., Maeda S., Deguchi T. Mycoplasma genitalium urethritis in men // Int. J. Antimicrob. Agents. — 2004. — V. 24. — P. 23—27.
30. Jensen S.J, Uldum S.A., Sondergard_Andersen J., Vuust J., Lind K. Polymerase chain reaction for detection of Mycoplasma genitalium in clinical samples // J. Clinic. Microbiol. — 1991. — V. 29. — P. 46—50.
31. Jensen S.J., Orsum R., Dohn В., Uldum S., Worm A._M., Lind K. Mycoplasma genitalium: a cause of male urethritis? // Genitourin Med. — 1993. — V. 69. — P. 265—269.
32. Jensen S.J., Hansen H.T., Lind K. Isolation of Mycoplasma genitalium strains from the male urethra // J. Clinic. Microbiol. — 1996. — V. 34. — P. 286—291.
33. Khryanin A.A. Mycoplasma genitalium: rational method of treatment // J. EADV. — 2003. — V. 17. — P. 416—417.
34. McMillan A., Scott G.R. Sexually transmitted infections (Second edition). — Published: Churchill Livingstone, 2000. — P. 123.
35. Mroczkowski T.F., Mena L., Nsuami M., Martin D.H. A randomized comparison of azitromycin and doxycycline for the treatment of Mycoplasma genitalium positive urethritis in men. Book of abstracts 16th Biennial meeting of tie ISSTDR, Amsterdam, 10—13 July, 2005, P. 304—305.
36. Paavonen J., Miettinen A., Stevens C.E., Kiviat N., Kio C.C., Stamm W.E. Mycoplasma hominis in cervicitis and endometritis // Sex Transm. Dis. — 1983. — V. 10. — P. 276—280.
37. Perez_Casas C., Herranz E., Ford N. Pricing of drugs and donations: options for sustainable equity pricing // Trop Med. Int. Health. — 2001. — V. 6. — P. 960—964.
38. Schlicht M.J., Lovrich S.D., Sartin J.S. et al. High prevalence of genital mycoplasmas among sexually active young adults with urethcitis or cervicitis sym_ ptoms in La Crosse, Wisconsin // J. Clin. Microbiol. — 2004. — V. 42. — P. 4636—4640.
39. Svenstrup H.F., Fedder J., Abraham_Peskir J. Mycoplasma genitalium attaches to human spermatozoa // Hum. Reprod. — 2003. — V. 18. —
P. 2103 —2109.
40. Taylor-Robinson D. Genital mycoplasma infections // Clin. Lab. Med. — 1989. — V. 9. — P. 501—523.
41. Taylor-Robinson D. The history and role of Mycoplasma genitalium in sexually transmitted diseases // Genitourin. Med. — 1995. — V. 71. — P. 1—8
42. Taylor-Robinson D. Mycoplasma genitalium — an up_date // Int. J. STD AIDS. — 2002. — V. 13. — P. 145—151.
43. Taylor-Robinson D., Furr P.M. Update on sexually transmitted mycoplasmas // Lancet. — 1998. — V. 351. — P. 12—15.
44. Taylor-Robinson D., Gilroy C.B., Thomas B.J., Hay P.E. Mycoplasma genitalium in chronic non_gonococcal urethritis // Int. J. STD AIDS. — 2004. — V. 15. — P. 21—25.
45. Taylor-Robinson D., Jensen S.J., Fehler G., Radebe F., Ballard R.C. Observations' on the microbiology of urethritis in black South African men // Int. J. STD AIDS. — 2002. — V. 13. — P. 323—325.
46. Taylor-Robinson D., Renton A. Diagnostic test that are worthwhile for patients with sexually transmitted bacterial infections in industrialized countries // J. STD & AIDS. — 1999. — V. 10 (1). — P. 1—4.
47. Tully J.G., Taylor-Robinson D., Cole R.M., Rose D.L. A newly discovered mycoplasma in the human urogenital tract // Lancet. — 1981. —
V. 1. — P. 1288—1291.
48. Tully J.G., Taylor-Robinson D., Rose D.L., Furr P.M., Graham C.E., Barile M.F. Urogenital challenge of primate species with Mycoplasma genitalium and characteristics of infection induced in chimpanzees // J. Infect. Dis. — 1986. — V. 153. — P. 1046—1054.
49. Uuskula A., Kohl P.K. Genital mycoplasmas, including Mycoplasma genitalium, as sexually transmitted agents // Int. J. STD AIDS. — 2002. — V. 13. — P. 79—85.
50. Wisdom A., Hawkins D. Sexually transmitted diseases (Second edition). — Published: Mosby—Wolfe, 1997. — P. 336.
Ключевые слова: вагинальный биоценоз, возрастная динамика, антибиотико- и пробиотикотерапия, бактериальный вагиноз, Симбитер-2.
Ключові слова: вагінальний біоценоз, вікова динаміка, антибіотико- та пробіотикотерапія, бактеріальний вагіноз, Симбітер-2.
Key words: vaginal biocenosis, age dynamics, antibiotic and probiotic therapy, bacterial vaginosis, Symbiter-2.
Реклама:
главные новости
протезирование зубов штифты. | Начни свой бизнес сегодня, новости шоу-бизнеса.
��� ������ � �����:
��������. ����������
���������� ����� ������:
http://old.medexpert.org.ua/modules/myarticles/article_storyid_325.html
�������:
�������� �����
������� ��������
��������. ������� �������
��������. ������� �������
|







