РҹР РҳРңР•РқР•РқРҳР• РҰР•РӨРҹРһР”РһРҡРЎРҳРңРҗ РҹР РһРҡСЕТРҳРӣРҗ РҹР Рҳ РӣЕЧЕРқРҳРҳ Р’РқЕБРһРӣР¬РқРҳР§РқР«РҘ РҹРқЕВРңРһРқРҳРҷ РЈ Р§РҗРЎРўРһ Р‘РһРӣЕЮЩРҳРҘ ДЕТЕРҷ Р РҗРқРқЕГРһ Р’РһР—Р РҗРЎРўРҗ
Дата: 2009/9/23 | Раздел: РЎРҫРІСҖРөРјРөРҪРҪР°СҸ РҝРөРҙРёР°СӮСҖРёСҸ
Рҗ.Р•. РҗРұР°СӮСғСҖРҫРІ, Рһ.Рқ. Р“РөСҖР°СҒРёРјРөРҪРәРҫ
Р”РҪРөРҝСҖРҫРҝРөСӮСҖРҫРІСҒРәР°СҸ РіРҫСҒСғРҙР°СҖСҒСӮРІРөРҪРҪР°СҸ РјРөРҙРёСҶРёРҪСҒРәР°СҸ Р°РәР°РҙРөРјРёСҸ
Р РөР·СҺРјРө. Р’ СҒСӮР°СӮСҢРө РҝСҖРөРҙСҒСӮавлРөРҪСӢ лиСӮРөСҖР°СӮСғСҖРҪСӢРө РҙР°РҪРҪСӢРө РҫРұ Р°РҪСӮРёРұР°РәСӮРөСҖиалСҢРҪРҫР№ Р°РәСӮРёРІРҪРҫСҒСӮРё СҶРөС„РҝРҫРҙРҫРәСҒРёРјР° РҝСҖРҫРәСҒРөСӮила Рё СҖРөР·СғР»СҢСӮР°СӮСӢ РёР·СғСҮРөРҪРёСҸ РәлиРҪРёСҮРөСҒРәРҫР№ СҚффРөРәСӮРёРІРҪРҫСҒСӮРё РҝСҖРөРҝР°СҖР°СӮР° В«РҰРөС„РҫРҙРҫРәСҒВ» РҝСҖРё Р»РөСҮРөРҪРёРё РІРҪРөРіРҫСҒРҝРёСӮалСҢРҪСӢС… РҝРҪРөРІРјРҫРҪРёР№ Сғ СҮР°СҒСӮРҫ РұРҫР»РөСҺСүРёС… РҙРөСӮРөР№ СҖР°РҪРҪРөРіРҫ РІРҫР·СҖР°СҒСӮР°. ДаРҪРҫ РҝРҫРҪСҸСӮРёРө Рҫ РұРёРҫРҝР»РөРҪРәРө РәР°Рә РҪР°РҙРҫСҖРіР°РҪРёР·РјРөРҪРҪРҫР№ (РұРёРҫСҒРҫСҶиалСҢРҪРҫР№) СҒРёСҒСӮРөРјРө, С„СғРҪРәСҶРёРҫРҪалСҢРҪРҫ РәРҫРҫСҖРҙРёРҪРёСҖРҫРІР°РҪРҪРҫР№ РәРҫР»РҫРҪРёРё РұР°РәСӮРөСҖРёР№ Рё РөРө СҖРҫли РІ С„РҫСҖРјРёСҖРҫРІР°РҪРёРё СҖРөР·РёСҒСӮРөРҪСӮРҪРҫСҒСӮРё Рә РҙРөР№СҒСӮРІРёСҺ Р°РҪСӮРёРұР°РәСӮРөСҖиалСҢРҪСӢС… РҝСҖРөРҝР°СҖР°СӮРҫРІ.
Р РөР·СҺРјРө. РЈ СҒСӮР°СӮСӮС– РҝСҖРөРҙСҒСӮавлРөРҪС– ліСӮРөСҖР°СӮСғСҖРҪС– РҙР°РҪС– СүРҫРҙРҫ Р°РҪСӮРёРұР°РәСӮРөСҖіалСҢРҪРҫС— Р°РәСӮРёРІРҪРҫСҒСӮС– СҶРөС„РҝРҫРҙРҫРәСҒРёРјСғ РҝСҖРҫРәСҒРөСӮРёР»Сғ СӮР° СҖРөР·СғР»СҢСӮР°СӮРё РІРёРІСҮРөРҪРҪСҸ РәліРҪС–СҮРҪРҫС— РөС„РөРәСӮРёРІРҪРҫСҒСӮС– РҝСҖРөРҝР°СҖР°СӮСғ В«РҰРөС„РҫРҙРҫРәСҒВ» РҝСҖРё ліРәСғРІР°РҪРҪС– РҝРҫзаліРәР°СҖРҪСҸРҪРёС… РҝРҪРөРІРјРҫРҪС–Р№ Сғ СҮР°СҒСӮРҫ С…РІРҫСҖС–СҺСҮРёС… РҙС–СӮРөР№ СҖР°РҪРҪСҢРҫРіРҫ РІС–РәСғ. ДаРҪРҫ РҝРҫРҪСҸСӮСӮСҸ РҝСҖРҫ РұС–Рҫ-РҝлівРәСғ СҸРә РҪР°РҙРҫСҖРіР°РҪС–Р·РјРөРҪРҪСғ (РұС–РҫСҒРҫСҶіалСҢРҪСғ) СҒРёСҒСӮРөРјСғ, С„СғРҪРәСҶС–РҫРҪалСҢРҪРҫ РәРҫРҫСҖРҙРёРҪРҫРІР°РҪСғ РәРҫР»РҫРҪС–СҺ РұР°РәСӮРөСҖС–Р№ СӮР° С—С— СҖРҫР»СҢ Сғ С„РҫСҖРјСғРІР°РҪРҪС– СҖРөР·РёСҒСӮРөРҪСӮРҪРҫСҒСӮС– РҙРҫ РҙС–С— Р°РҪСӮРёРұР°РәСӮРөСҖіалСҢРҪРёС… РҝСҖРөРҝР°СҖР°СӮС–РІ.
Summary. In this article the literature data about the antibacterial activity of cefpodoxime proxetil and the results of study of clinical efficacy of the medicine В«CefodoxВ» for the treatment of outhospital pneumonia in early age children with repeated infections of upper respiratory tract are presented. The understanding of the biofilm as an overorganism (biosocial) system, functionally coordinated colony of bacteria and its role in forming resistance to the action of antibacterial drugs is presented.
Р’СҒСӮСғРҝР»РөРҪРёРө
Р’ РҪР°СҒСӮРҫСҸСүРөРө РІСҖРөРјСҸ РҪР°РұР»СҺРҙР°РөСӮСҒСҸ РҝРөСҖРөС…РҫРҙ РҫСӮ СӮСҖР°РҙРёСҶРёРҫРҪРҪРҫРіРҫ РҝСҖРөРҙСҒСӮавлРөРҪРёСҸ Рҫ РұР°РәСӮРөСҖРёСҸС… РәР°Рә СҒСӮСҖРҫРіРҫ РҫРҙРҪРҫРәР»РөСӮРҫСҮРҪСӢС… РҫСҖРіР°РҪизмах Рә РҝСҖРөРҙСҒСӮавлРөРҪРёСҺ Рҫ РјРёРәСҖРҫРұРҪСӢС… СҒРҫРҫРұСүРөСҒСӮвах РәР°Рә СҶРөР»РҫСҒСӮРҪСӢС… СҒСӮСҖСғРәСӮСғСҖах, СҖРөРіСғлиСҖСғСҺСүРёС… СҒРІРҫРё РҝРҫРІРөРҙРөРҪСҮРөСҒРәРёРө СҖРөР°РәСҶРёРё РІ завиСҒРёРјРҫСҒСӮРё РҫСӮ РёР·РјРөРҪРөРҪРёСҸ СғСҒР»РҫРІРёР№ РҫРұРёСӮР°РҪРёСҸ. Р’ СҒРҫРІСҖРөРјРөРҪРҪРҫР№ РјРёРәСҖРҫРұРёРҫР»РҫРіРёРё РҪамРөСҮР°РөСӮСҒСҸ РҝРҫСҒСӮРөРҝРөРҪРҪСӢР№ РҝРөСҖРөС…РҫРҙ Рә РұРёРҫСҒРҫСҶиалСҢРҪРҫРјСғ (В«РұРёРҫРҝРҫлиСӮРёСҮРөСҒРәРҫРјСғВ») РјРёСҖРҫРІРҫР·Р·СҖРөРҪСҮРөСҒРәРҫРјСғ РҝРҫРҙС…РҫРҙСғ Рә РҝРҫРҪРёРјР°РҪРёСҺ жизРҪРё РјРёРәСҖРҫРҫСҖРіР°РҪРёР·РјРҫРІ. РҡРҫР»РҫРҪРёРё РҝСҖР°РәСӮРёСҮРөСҒРәРё РІСҒРөС… РІРёРҙРҫРІ РұР°РәСӮРөСҖРёР№ РҙРөРјРҫРҪСҒСӮСҖРёСҖСғСҺСӮ СҒРҝРҫСҒРҫРұРҪРҫСҒСӮСҢ Рә РәР»РөСӮРҫСҮРҪРҫР№ РҙиффРөСҖРөРҪСҶРёСҖРҫРІРәРө Рё РјРҪРҫРіРҫРәР»РөСӮРҫСҮРҪРҫР№ РҫСҖРіР°РҪРёР·Р°СҶРёРё. РӯСӮР° СҒРҝРҫСҒРҫРұРҪРҫСҒСӮСҢ РҪаиРұРҫР»РөРө РҫСҮРөРІРёРҙРҪРҫ РҝСҖРҫСҸРІР»СҸРөСӮСҒСҸ РҝСҖРё СҖРҫСҒСӮРө РұР°РәСӮРөСҖРёР№ РІ РёС… РҝСҖРёСҖРҫРҙРҪСӢС… РјРөСҒСӮах РҫРұРёСӮР°РҪРёСҸ, РіРҙРө РҫРҪРё С„РҫСҖРјРёСҖСғСҺСӮ СҖазлиСҮРҪСӢРө РјРҪРҫРіРҫРәР»РөСӮРҫСҮРҪСӢРө СҒСӮСҖСғРәСӮСғСҖСӢ: РұРёРҫРҝР»РөРҪРәРё, РұР°РәСӮРөСҖиалСҢРҪСӢРө РјР°СӮСӢ, РҝР»РҫРҙРҫРІСӢРө СӮРөла Рё РҙСҖ. [1,2,8,9,16].
БаРәСӮРөСҖРёРё РІ РәРҫР»РҫРҪРёРё РҪахРҫРҙСҸСӮСҒСҸ РІ СӮРөСҒРҪРҫР№ РәР»РөСӮРҫСҮРҪРҫ-РәР»РөСӮРҫСҮРҪРҫР№ РәРҫРјРјСғРҪРёРәР°СҶРёРё. Р“СҖамРҝРҫР»РҫжиСӮРөР»СҢРҪСӢРө Рё РіСҖамРҫСӮСҖРёСҶР°СӮРөР»СҢРҪСӢРө РұР°РәСӮРөСҖРёРё РәРҫР»РҫРҪРёРё РұРёРҫРҝР»РөРҪРәРё, взаимРҫРҙРөР№СҒСӮРІСғСҸ СҒ СҖазРҙСҖажиСӮРөР»РөРј, РҝСҖРҫРҙСғСҶРёСҖСғСҺСӮ СҒРёРіРҪалСҢРҪСӢРө Рё В«СҒРөРҪСҒРёРҪРіРҫРІСӢРөВ» РјРҫР»РөРәСғР»СӢ, РәРҫСӮРҫСҖСӢРө СҖРөРіСғлиСҖСғСҺСӮ РҙРөСҸСӮРөР»СҢРҪРҫСҒСӮСҢ РәРҫР»РҫРҪРёРё. РһРҙРҪР° РёР· С„РҫСҖРј РәР»РөСӮРҫСҮРҪРҫРәР»РөСӮРҫСҮРҪРҫР№ РәРҫРјРјСғРҪРёРәР°СҶРёР№ РұР°РәСӮРөСҖиалСҢРҪСӢС… РәРҫР»РҫРҪРёР№ РҝРҫР»СғСҮила РҪазваРҪРёРө Quorum Sensing. РҹРҫРҪСҸСӮРёРө В«РҫСүСғСүРөРҪРёРө РәРІРҫСҖСғма» (Quorum Sensing) РұСӢР»Рҫ РҝСҖРөРҙР»РҫР¶РөРҪРҫ РІ 1994 Рі. РһРҪРҫ РҫР·РҪР°СҮР°РөСӮ РІРҫСҒРҝСҖРёСҸСӮРёРө РәР»РөСӮРәами РёР·РјРөРҪРөРҪРёР№ СҒСҖРөРҙСӢ, РәРҫСӮРҫСҖСӢРө РҪР°СҒСӮСғРҝР°СҺСӮ РҝСҖРё РҙРҫСҒСӮРёР¶РөРҪРёРё РұР°РәСӮРөСҖиалСҢРҪРҫР№ РәСғР»СҢСӮСғСҖРҫР№ РҪРөРәРҫСӮРҫСҖРҫР№ РҝРҫСҖРҫРіРҫРІРҫР№ СҮРёСҒР»РөРҪРҪРҫСҒСӮРё, Рё СҖРөР°РәСҶРёСҺ РҪР° СҚСӮРё РёР·РјРөРҪРөРҪРёСҸ. Quorum sensing РёРҙРөРҪСӮифиСҶРёСҖРҫРІР°РҪ РІ РәРҫР»РҫРҪРёСҸС… РіСҖамм-РҝРҫР»РҫжиСӮРөР»СҢРҪСӢС… РұР°РәСӮРөСҖРёР№ (Str. pneumoniae, Bacillus subtilis, St. aureus), РіСҖамРҫСӮСҖРёСҶР°СӮРөР»СҢРҪСӢС… РұР°РәСӮРөСҖРёР№ (V. fischeri, P. aeruginosa, Agrobacterium tumefaciens, Erwinia carotovora). БаРәСӮРөСҖРёРё РҝСҖРҫРҙСғСҶРёСҖСғСҺСӮ С…РёРјРёСҮРөСҒРәРёРө СҒСғРұСҒСӮР°РҪСҶРёРё, РҝРҫР»СғСҮРёРІСҲРёРө РҪазваРҪРёРө Р°СғСӮРҫРёРҪРҙСғРәСӮРҫСҖСӢ. РЎ СғРІРөлиСҮРөРҪРёРөРј РҝР»РҫСӮРҪРҫСҒСӮРё РәРҫР»РҫРҪРёРё СғРІРөлиСҮРёРІР°РөСӮСҒСҸ Рё РәРҫРҪСҶРөРҪСӮСҖР°СҶРёСҸ Р°СғСӮРҫРёРҪРҙСғРәСӮРҫСҖРҫРІ.
Р”РҫСҒСӮРёРіРҪСғРІ РҫРҝСҖРөРҙРөР»РөРҪРҪРҫР№ РәРҫРҪСҶРөРҪСӮСҖР°СҶРёРё, Р°СғСӮРҫРёРҪРҙСғРәСӮРҫСҖСӢ СҒРІСҸР·СӢРІР°СҺСӮСҒСҸ СҒ РёС… СҖРөСҶРөРҝСӮРҫСҖами РҪР° РҝРҫРІРөСҖС…РҪРҫСҒСӮРё РјРөРјРұСҖР°РҪ СҒРҫСҒРөРҙРҪРёС… РұР°РәСӮРөСҖРёР№ (РҙРҫСҒСӮРёР¶РөРҪРёРө РәРІРҫСҖСғРјР°), Р°РәСӮРёРІРёСҖСғСҺСӮ РІРҪСғСӮСҖРёРұР°РәСӮРөСҖиалСҢРҪСӢРө СҒРёРіРҪалСҢРҪСӢРө РҝСғСӮРё, РҝРҫРҙ РҙРөР№СҒСӮРІРёРөРј РәРҫСӮРҫСҖСӢС… РјРөРҪСҸРөСӮСҒСҸ СҚРәСҒРҝСҖРөСҒСҒРёСҸ РҫРҝСҖРөРҙРөР»РөРҪРҪСӢС… РіРөРҪРҫРІ.
Р’СӢР·РІР°РҪРҪСӢРө Р°СғСӮРҫРёРҪРҙСғРәСӮРҫСҖами РёР·РјРөРҪРөРҪРёСҸ СӮСҖР°РҪСҒРәСҖРёРҝСҶРёРҫРҪРҪРҫР№ Р°РәСӮРёРІРҪРҫСҒСӮРё РіРөРҪРҫРІ РҫРұСғСҒлавливаСҺСӮ СғСҒРёР»РөРҪРёРө Р·Р°СүРёСӮРҪРҫР№ РұРёРҫР»СҺРјРёРҪРөСҒСҶРөРҪСҶРёРё, РІРёСҖСғР»РөРҪСӮРҪРҫСҒСӮРё, РҝСҖРҫРҙСғРәСҶРёРё РұР°РәСӮРөСҖРёСҶРёРҙРҪСӢС… РҝРөРҝСӮРёРҙРҫРІ Рё С„РҫСҖРјРёСҖРҫРІР°РҪРёРө РұРёРҫРҝР»РөРҪРәРё [5,6]. Р’ РҝРҫСҒР»РөРҙРҪРөРө РІСҖРөРјСҸ СғСҒСӮР°РҪРҫРІР»РөРҪРҫ, СҮСӮРҫ РҫРәРҫР»Рҫ 65% РұР°РәСӮРөСҖиалСҢРҪСӢС… РёРҪС„РөРәСҶРёР№, РҝРҫСҖажаСҺСүРёС… СҮРөР»РҫРІРөРәР°, РјРҫРіСғСӮ РҫСҖРіР°РҪРёР·РҫРІСӢРІР°СӮСҢ РұРёРҫРҝР»РөРҪРәСғ. БиРҫРҝР»РөРҪРәР° вҖ” СҚСӮРҫ С„СғРҪРәСҶРёРҫРҪалСҢРҪРҫ РәРҫРҫСҖРҙРёРҪРёСҖРҫРІР°РҪРҪР°СҸ, СҒРІСҸР·Р°РҪРҪР°СҸ СҒ РҝРҫРІРөСҖС…РҪРҫСҒСӮСҢСҺ РҫРұСҠРөРәСӮР° РІ Р·Р°СүРёСӮРҪРҫР№ РҝРҫлиСҒахаСҖРёРҙРҪРҫР№ РҫРұРҫР»РҫСҮРәРө РәРҫР»РҫРҪРёСҸ Р°СҒСҒРҫСҶРёРёСҖРҫРІР°РҪРҪСӢС… РјРөР¶РҙСғ СҒРҫРұРҫР№ РұР°РәСӮРөСҖРёР№ СҒ СҒРёРҪС…СҖРҫРҪРёР·РёСҖРҫРІР°РҪРҪРҫР№ РіРөРҪРҪРҫР№ СҚРәСҒРҝСҖРөСҒСҒРёРөР№. Р’ РҝСҖРөРҙРөлах РҫРҙРҪРҫР№ РұРёРҫРҝР»РөРҪРәРё РјРҫРіСғСӮ СҒРҫСҒСғСүРөСҒСӮРІРҫРІР°СӮСҢ РіСҖамРҝРҫР»РҫжиСӮРөР»СҢРҪСӢРө Рё РіСҖамРҫСӮСҖРёСҶР°СӮРөР»СҢРҪСӢРө РұР°РәСӮРөСҖРёРё Рё РіСҖРёРұСӢ. БаРәСӮРөСҖРёРё РІ РұРёРҫРҝР»РөРҪРәах РҫСӮРҙРөР»РөРҪСӢ РҫСӮ СҒРІРҫРұРҫРҙРҪРҫ РҝлаваСҺСүРёС… РҝлаРҪРәСӮРҫРҪРҪСӢС… С„РҫСҖРј РІРҪРөРәР»РөСӮРҫСҮРҪРҫР№ РҝРҫлимРөСҖРҪРҫР№ СҒСғРұСҒСӮР°РҪСҶРёРөР№ Рё С…Р°СҖР°РәСӮРөСҖРёР·СғСҺСӮСҒСҸ РұРҫР»РөРө РјРөРҙР»РөРҪРҪСӢРј СӮРөРјРҝРҫРј СҖРҫСҒСӮР°, СҒРҪРёР¶РөРҪРҪСӢРј СҖРөРіСғлиСҖРҫРІР°РҪРёРөРј РҫРҝСҖРөРҙРөР»РөРҪРҪСӢС… РіРөРҪРҫРІ Рё РІСӢСҒРҫРәРёРј СғСҖРҫРІРҪРөРј РҫРұРјРөРҪР° РҝлазмиРҙ [16,19].
РӯРәСҒРҝРөСҖРёРјРөРҪСӮалСҢРҪРҫ РҝРҫРәазаРҪРҫ, СҮСӮРҫ РҪР°СҮалСҢРҪСӢРө СҚР»РөРјРөРҪСӮСӢ РұРёРҫРҝР»РөРҪРәРё РјРҫРіСғСӮ СҒС„РҫСҖРјРёСҖРҫРІР°СӮСҢСҒСҸ РІ СӮРөСҮРөРҪРёРө РҙРІСғС… СҮР°СҒРҫРІ РёРҪРәСғРұР°СҶРёРё, РҙРҫСҒСӮРёРіР°СҸ РјР°РәСҒималСҢРҪРҫР№ РёРҪСӮРөРҪСҒРёРІРҪРҫСҒСӮРё СғР¶Рө СҮРөСҖРөР· 24 СҮР°СҒР° [7]. БаРәСӮРөСҖРёРё РұРёРҫРҝР»РөРҪРәРё РұРҫР»РөРө СғСҒСӮРҫР№СҮРёРІСӢ Рә РҙРөР№СҒСӮРІРёСҺ Р°РҪСӮРёРұРёРҫСӮРёРәРҫРІ, СҮРөРј РёС… РҝлаРҪРәСӮРҫРҪРҪСӢРө РұР°РәСӮРөСҖРёРё, РІ СҒРІСҸР·Рё СҒ Р·Р°СүРёСӮРҪРҫР№ С„СғРҪРәСҶРёРөР№ РҝР»РөРҪРәРё, РҝСҖРҫСҒСӮСҖР°РҪСҒСӮРІРөРҪРҪРҫ СҖазРҫРұСүР°СҺСүРөР№ РұР°РәСӮРөСҖРёРё Рё Р°РҪСӮРёРұРёРҫСӮРёРәРё Рё СҒРҫР·РҙР°СҺСүРөР№ РұлагРҫРҝСҖРёСҸСӮРҪСғСҺ СҒСҖРөРҙСғ РІ РҝСҖРөРҙРөлах РҝР»РөРҪРәРё. Р’ СҖРөР·СғР»СҢСӮР°СӮРө РұР°РәСӮРөСҖРёРё РІ РұРёРҫРҝР»РөРҪРәах РҫСҒСӮР°СҺСӮСҒСҸ РІ живСӢС… РҝСҖРё РәРҫРҪСҶРөРҪСӮСҖР°СҶРёСҸС… Р°РҪСӮРёРұРёРҫСӮРёРәРҫРІ, РәРҫСӮРҫСҖСӢРө РІ 1000 СҖаз РІСӢСҲРө СҒРјРөСҖСӮРөР»СҢРҪСӢС… РәРҫРҪСҶРөРҪСӮСҖР°СҶРёР№ РҙР»СҸ РҝлаРҪРәСӮРҫРҪРҪСӢС…
РұР°РәСӮРөСҖРёР№. Р‘СӢли РҝСҖРөРҙР»РҫР¶РөРҪСӢ СӮСҖРё РјРөС…Р°РҪРёР·РјР°, РҫРұСҠСҸСҒРҪСҸСҺСүРёРө СҖРөР·РёСҒСӮРөРҪСӮРҪРҫСҒСӮСҢ РұР°РәСӮРөСҖиалСҢРҪСӢС… РәРҫР»РҫРҪРёР№ РұРёРҫРҝР»РөРҪРҫРә Рә РҙРөР№СҒСӮРІРёСҺ Р°РҪСӮРёРұР°РәСӮРөСҖиалСҢРҪСӢС… РҝСҖРөРҝР°СҖР°СӮРҫРІ: СҒРҪРёР¶РөРҪРёРө СғСҖРҫРІРҪСҸ РҝСҖРҫРҪРёРәРҪРҫРІРөРҪРёСҸ Р°РҪСӮРёРұР°РәСӮРөСҖиалСҢРҪРҫРіРҫ РҝСҖРөРҝР°СҖР°СӮР° РІ РұР°РәСӮРөСҖРёРё, РјРөРҙР»РөРҪРҪСӢР№ СҖРҫСҒСӮ РұР°РәСӮРөСҖРёР№, РёРҪРҙСғРәСҶРёСҸ РұРёРҫРҝР»РөРҪРҫСҮРҪРҫРіРҫ С„РөРҪРҫСӮРёРҝР° [17]. РҹСҖРөРҙСҒСӮавлРөРҪСӢ РҙРҫРәазаСӮРөР»СҢСҒСӮРІР° Рҫ Р·РҪР°СҮРөРҪРёРё СҖазвиСӮРёСҸ РұРёРҫРҝР»РөРҪРҫРә РҝСҖРё РјСғРәРҫРІРёСҒСҶРёРҙРҫР·Рө [15], С…СҖРҫРҪРёСҮРөСҒРәРёС… РҪРөСҒРҝРөСҶифиСҮРөСҒРәРёС… Р·Р°РұРҫР»РөРІР°РҪРёСҸС… РҫСҖРіР°РҪРҫРІ РҙСӢС…Р°РҪРёСҸ Сғ РІР·СҖРҫСҒР»СӢС….
РҹРҫ РјРҪРөРҪРёСҺ Рҗ. ГиРҪСҶРұСғСҖРі (2006), РҫСҮаги РұРёРҫРҝР»РөРҪРҫРә РҝРҫСҸРІР»СҸСҺСӮСҒСҸ РҝСҖРё РІСҒРөС… СҖРөСҶРёРҙРёРІРёСҖСғСҺСүРёС… РёРҪС„РөРәСҶРёРҫРҪРҪРҫ-РІРҫСҒРҝалиСӮРөР»СҢРҪСӢС… Р·Р°РұРҫР»РөРІР°РҪРёСҸС…, РІ СҮР°СҒСӮРҪРҫСҒСӮРё РұСҖРҫРҪС…РҫР»РөРіРҫСҮРҪСӢС…. РҡРҫРіРҙР° РұРёРҫРҝР»РөРҪРәРё РҙРҫСҒСӮРёРіР°СҺСӮ РҫРҝСҖРөРҙРөР»РөРҪРҪРҫРіРҫ СҖазмРөСҖР°, РҫСӮ РҪРёС… РҪР°СҮРёРҪР°СҺСӮ РҫСӮСҖСӢРІР°СӮСҢСҒСҸ СҮР°СҒСӮРё, РәРҫСӮРҫСҖСӢРө СҖазРҪРҫСҒСҸСӮСҒСҸ СҒ РәСҖРҫРІРҫСӮРҫРәРҫРј или РҝРҫ РҝРёСүРөРІР°СҖРёСӮРөР»СҢРҪРҫРјСғ СӮСҖР°РәСӮСғ РҝРҫ РҫСҖРіР°РҪРёР·РјСғ. РҹСҖРҫРёСҒС…РҫРҙРёСӮ РҫРұСҖазРҫРІР°РҪРёРө РҪРҫРІСӢС… РҫСҮагРҫРІ РұРёРҫРҝР»РөРҪРәРё, СҮСӮРҫ СҸРІР»СҸРөСӮСҒСҸ Р°РҪалРҫРіРҫРј РјРөСӮР°СҒСӮазиСҖРҫРІР°РҪРёСҸ Р·Р»РҫРәР°СҮРөСҒСӮРІРөРҪРҪСӢС… РәР»РөСӮРҫРә.
Р’ РҝРҫСҒР»РөРҙРҪРёРөРіРҫРҙСӢ РҫСӮРјРөСҮР°РөСӮСҒСҸ РҪРөСғРәР»РҫРҪРҪР°СҸ СӮРөРҪРҙРөРҪСҶРёСҸ СҖР°СҒРҝСҖРҫСҒСӮСҖР°РҪРөРҪРёСҸ РҝРөРҪРёСҶиллиРҪСҖРөР·РёСҒСӮРөРҪСӮРҪСӢС… СҲСӮаммРҫРІ Str. pneumoniae, СғСҒСӮРҫР№СҮРёРІСӢС… Рә амиРҪРҫРҝРөРҪРёСҶиллиРҪам, СҶРөфалРҫСҒРҝРҫСҖРёРҪам IвҖ“II РҝРҫРәРҫР»РөРҪРёР№ Рё РјР°РәСҖРҫлиРҙам, РІ СӮРҫ Р¶Рө РІСҖРөРјСҸ РҝРҫРәазаРҪРҫ влиСҸРҪРёРө РҪР° жизРҪРөРҙРөСҸСӮРөР»СҢРҪРҫСҒСӮСҢ РұР°РәСӮРөСҖРёР№ РұРёРҫРҝР»РөРҪРҫРә СҶРөфалРҫСҒРҝРҫСҖРёРҪРҫРІ III РҝРҫРәРҫР»РөРҪРёСҸ вҖ” СҶРөС„РҝРҫРҙРҫРәСҒРёРјР°, СҶРөфамаРҪРҙРҫла вҖ” РІ СҒРҫСҮРөСӮР°РҪРёРё СҒ РҙРёСҒРҝРөСҖСҒРёРҪРҫРј B. РҰРөС„РҝРҫРҙРҫРәСҒРёРј РҝСҖРҫРәСҒРөСӮРёР» вҖ” РҫСҖалСҢРҪСӢР№ СҶРөфалРҫСҒРҝРҫСҖРёРҪ СӮСҖРөСӮСҢРөР№ РіРөРҪРөСҖР°СҶРёРё, РҫРұлаРҙР°СҺСүРёР№ РІСӢСҒРҫРәРҫР№ Р°РҪСӮРёРұР°РәСӮРөСҖиалСҢРҪРҫР№ Р°РәСӮРёРІРҪРҫСҒСӮСҢСҺ РҫСӮРҪРҫСҒРёСӮРөР»СҢРҪРҫ СҲРёСҖРҫРәРҫРіРҫ СҒРҝРөРәСӮСҖР° РіСҖамРҝРҫ-Р»РҫжиСӮРөР»СҢРҪСӢС… Рё РіСҖамРҫСӮСҖРёСҶР°СӮРөР»СҢРҪСӢС… РұР°РәСӮРөСҖРёР№.
РҰРөС„РҝРҫРҙРҫРәСҒРёРј РҝРҫРәазал С…РҫСҖРҫСҲСғСҺ Р°РҪСӮРёРұР°РәСӮРөСҖиалСҢРҪСғСҺ Р°РәСӮРёРІРҪРҫСҒСӮСҢ РҝСҖРҫСӮРёРІ St. pneumoniae, Haemophilus influenzae, РјРөСӮРёСҶилиРҪ-СҮСғРІСҒСӮРІРёСӮРөР»СҢРҪРҫРіРҫ Staphylococcus spp., Str. pyogenes, Str. agalactiae, Moraxella catarrhalis, Enterobacteriaceae Рё РҙСҖ. [13]. РҹСҖРҫРІРөРҙРөРҪРҪСӢРө РІ РҳСҒРҝР°РҪРёРё РёСҒСҒР»РөРҙРҫРІР°РҪРёСҸ (2007 Рі.) РҝРҫРәазали, СҮСӮРҫ СҲСӮаммСӢ Str. pneumoniae, РҪРөСҮСғРІСҒСӮРІРёСӮРөР»СҢРҪСӢРө Рә РҙРөР№СҒСӮРІРёСҺ РҝРөРҪРёСҶиллиРҪР°, СҮСғРІСҒСӮРІРёСӮРөР»СҢРҪСӢ Рә СҶРөС„РҝРҫРҙРҫРәСҒРёРјСғ РІ 99,5% СҒР»СғСҮР°РөРІ [14].
РҹРҫ РҙР°РҪРҪСӢРј Z.Y. Sun Рё СҒРҫавСӮ. [11], СҮСғРІСҒСӮРІРёСӮРөР»СҢРҪРҫСҒСӮСҢ Str. pneumoniae Рә РҝРөСҖРІРҫРјСғ (СҶРөфалРөРәСҒРёРҪСғ), РІСӮРҫСҖРҫРјСғ (СҶРөфаРәР»РҫСҖСғ) Рё СӮСҖРөСӮСҢРөРјСғ (СҶРөС„РҝРҫРҙРҫРәСҒРёРјСғ) РҝРҫРәРҫР»РөРҪРёСҺ СҶРөфалРҫСҒРҝРҫСҖРёРҪРҫРІ СҒРҫСҒСӮавлСҸРөСӮ 6,0%, 45,1% Рё 88,7% СҒРҫРҫСӮРІРөСӮСҒСӮРІРөРҪРҪРҫ. РҹСҖРё СҒСҖавРҪРёСӮРөР»СҢРҪРҫРј Р°РҪализРө Р°РҪСӮРёРұР°РәСӮРөСҖиалСҢРҪРҫР№ Р°РәСӮРёРІРҪРҫСҒСӮРё РҪаиРұРҫР»РөРө СҮР°СҒСӮРҫ РҪазРҪР°СҮР°РөРјСӢС… РҫСҖалСҢРҪСӢС… СҶРөфалРҫСҒРҝРҫСҖРёРҪРҫРІ (СҶРөфаРәР»РҫСҖР°, СҶРөС„РҙРёРҪРёСҖР°, СҶРөС„РҝРҫРҙРҫРәСҒРёРјР°, СҶРөС„РҝСҖРҫзила, СҶРөС„СғСҖРҫРәСҒРёРјР° Р°РәСҒРөСӮила, СҶРөфалРөРәСҒРёРҪР°) Рё амРҫРәСҒРёСҶиллиРҪР°/РәлавСғлаРҪР°СӮР° РұСӢР»Рҫ РҝРҫРәазаРҪРҫ, СҮСӮРҫ СҶРөС„РҝРҫРҙРҫРәСҒРёРј РҝРҫ Р°РәСӮРёРІРҪРҫСҒСӮРё РҫСӮРҪРҫСҒРёСӮРөР»СҢРҪРҫ H.influenzae РҝСҖРөРІРҫСҒС…РҫРҙРёСӮ РҙСҖСғРіРёРө СҒСҖРөРҙСҒСӮРІР° [10,18].
Р’ СҒСӮР°РҪРҙР°СҖСӮРҪРҫРј СҖРөжимРө СҶРөС„РҝРҫРҙРҫРәСҒРёРј РҪРө СғСҒСӮСғРҝР°РөСӮ или РҝСҖРөРІРҫСҒС…РҫРҙРёСӮ амРҫРәСҒРёСҶиллиРҪ СҒ РәлавСғлаРҪРҫРІРҫР№ РәРёСҒР»РҫСӮРҫР№, СҶРөфиРәСҒРёРј, СҶРөС„СғСҖРҫРәСҒРёРј Р°РәСҒРөСӮРёР», СҶРөфаРәР»РҫСҖ РҝСҖРё Р»РөСҮРөРҪРёРё РҙРөСӮРөР№ СҒ РұР°РәСӮРөСҖиалСҢРҪСӢРјРё РёРҪС„РөРәСҶРёСҸРјРё СҖРөСҒРҝРёСҖР°СӮРҫСҖРҪРҫРіРҫ СӮСҖР°РәСӮР° [12]. РўР°Рә, РҝРҫ РҙР°РҪРҪСӢРј 1090 РёСҒСҒР»РөРҙРҫРІР°РҪРёР№ 22 РұР°РәСӮРөСҖиалСҢРҪСӢС… СҲСӮаммРҫРІ 15 СҖазлиСҮРҪСӢС… РјРөРҙРёСҶРёРҪСҒРәРёС… СғСҮСҖРөР¶РҙРөРҪРёР№ РҜРҝРҫРҪРёРё, РҝСҖРҫРІРөРҙРөРҪРҪСӢС… Abe T. Рё СҒРҫавСӮ. [4] СҒ РёСҺРҪСҸ 2000 Рі. РҝРҫ РјР°СҖСӮ 2001 Рі., СҶРөС„РҝРҫРҙРҫРәСҒРёРј РҝСҖРөРІРҫСҒС…РҫРҙРёР» РҝРҫ Р°РҪСӮРёРұР°РәСӮРөСҖиалСҢРҪРҫР№ Р°РәСӮРёРІРҪРҫСҒСӮРё СҶРөфаРәР»РҫСҖ, СҶРөС„РҙРёРҪРёСҖ, СҶРөС„РҙРёСӮРҫСҖРөРҪ, СҶРөС„РәР°РҝРөРҪ. РЎСҮРёСӮР°РөСӮСҒСҸ, СҮСӮРҫ РІ СҖРөРіРёРҫРҪах, РіРҙРө РҪР°РұР»СҺРҙР°РөСӮСҒСҸ СҒРҪРёР¶РөРҪРёРө СҮСғРІСҒСӮРІРёСӮРөР»СҢРҪРҫСҒСӮРё СҖРөСҒРҝРёСҖР°СӮРҫСҖРҪРҫСӮСҖРҫРҝРҪСӢС… РёРҪС„РөРәСҶРёРҫРҪРҪСӢС… агРөРҪСӮРҫРІ Рә РҙРөР№СҒСӮРІРёСҺ РҝРөРҪРёСҶиллиРҪРҫРІ Рё РјР°РәСҖРҫлиРҙРҫРІ, СҶРөС„РҝРҫРҙРҫРәСҒРёРј РјРҫР¶РөСӮ РёСҒРҝРҫР»СҢР·РҫРІР°СӮСҢСҒСҸ РІ РәР°СҮРөСҒСӮРІРө РҝСҖРөРҝР°СҖР°СӮР° РІСӢРұРҫСҖР° [3].
БаРәСӮРөСҖиалСҢРҪСӢРө РҝСҖРҫСҶРөСҒСҒСӢ РҫСҖРіР°РҪРҫРІ РҙСӢС…Р°РҪРёСҸ Сғ СҮР°СҒСӮРҫ РұРҫР»РөСҺСүРёС… РҙРөСӮРөР№, РјРөС…Р°РҪРёР·РјСӢ Р·Р°СүРёСӮСӢ СҖРөСҒРҝРёСҖР°СӮРҫСҖРҪРҫРіРҫ СӮСҖР°РәСӮР° РәРҫСӮРҫСҖСӢС… С…Р°СҖР°РәСӮРөСҖРёР·СғСҺСӮСҒСҸ РҪРөРҙРҫСҒСӮР°СӮРҫСҮРҪРҫР№ Р°РәСӮРёРІРҪРҫСҒСӮСҢСҺ РҙРөС„РөРҪР·РёРҪРҫРІ, РәРҫллРөРәСӮРёРҪРҫРІ, СҚфалиРҪР°, лизРҫСҶРёРјР°, лаРәСӮРҫС„РөСҖСҖРёРҪР°, РәалРҝСҖРҫСӮРөРәСӮРёРҪР°, лаРәСӮРҫРҝРөСҖРҫРәСҒРёРҙазСӢ Рё РҙСҖСғРіРёС… фаРәСӮРҫСҖРҫРІ, РҝСҖРөРҙСғРҝСҖРөР¶РҙР°СҺСүРёС… взаимРҫРҙРөР№СҒСӮРІРёРө РұР°РәСӮРөСҖРёР№, РҝСҖРҫСӮРөРәР°СҺСӮ СҒ РІРҫР·РҪРёРәРҪРҫРІРөРҪРёРөРј РұРёРҫРҝР»РөРҪРәРё. РЈСҮРёСӮСӢРІР°СҸ СҒРҝРөРәСӮСҖ Р°РҪСӮРёРұР°РәСӮРөСҖиалСҢРҪРҫРіРҫ РҙРөР№СҒСӮРІРёСҸ Рё РҪалиСҮРёРө влиСҸРҪРёСҸ РҪР° РұРёРҫРҝР»РөРҪРәРё, СҶРөР»СҢСҺ РҪР°СҲРөР№ СҖР°РұРҫСӮСӢ СҸРІРёР»РҫСҒСҢ РёР·СғСҮРөРҪРёРө СҚффРөРәСӮРёРІРҪРҫСҒСӮРё СҶРөС„РҝРҫРҙРҫРәСҒРёРјР° РҝСҖРҫРәСҒРөСӮила РҝСҖРё РІРҪРөРіРҫСҒРҝРёСӮалСҢРҪСӢС… РҝРҪРөРІРјРҫРҪРёСҸС… Сғ СҮР°СҒСӮРҫ РұРҫР»РөСҺСүРёС… РҙРөСӮРөР№ СҖР°РҪРҪРөРіРҫ РІРҫР·СҖР°СҒСӮР°.
Р’ Р·Р°РҙР°СҮРё РёСҒСҒР»РөРҙРҫРІР°РҪРёСҸ РІС…РҫРҙРёР»Рҫ РёР·СғСҮРөРҪРёРө РәлиРҪРёСҮРөСҒРәРҫР№ СҚффРөРәСӮРёРІРҪРҫСҒСӮРё РҝСҖРёРјРөРҪРөРҪРёСҸ РҫСҖалСҢРҪРҫРіРҫ СҶРөфалРҫСҒРҝРҫСҖРёРҪР° III РіРөРҪРөСҖР°СҶРёРё СҶРөС„РҝРҫРҙРҫРәСҒРёРјР° РҝСҖРҫРәСҒРөСӮила (РҝСҖРөРҝР°СҖР°СӮ В«РҰРөС„РҫРҙРҫРәСҒВ» РҝСҖРөРҙСҒСӮавлРөРҪ РІ РЈРәСҖаиРҪРө РәРҫРјРҝР°РҪРёРөР№ В«РңРөРіР°РәРҫРјВ») РІ РәР°СҮРөСҒСӮРІРө СҒСӮР°СҖСӮРҫРІРҫРіРҫ Р°РҪСӮРёРұРёРҫСӮРёРәР° РҝСҖРё Р»РөСҮРөРҪРёРё РІРҪРөРұРҫР»СҢРҪРёСҮРҪСӢС… РҝРҪРөРІРјРҫРҪРёР№ Сғ СҮР°СҒСӮРҫ РұРҫР»РөСҺСүРёС… РҙРөСӮРөР№ СҖР°РҪРҪРөРіРҫ РІРҫР·СҖР°СҒСӮР°. РҰРөС„РҫРҙРҫРәСҒ СҒРҫРҙРөСҖжиСӮ РҪРөР°РәСӮРёРІРҪРҫРө СҒРҫРөРҙРёРҪРөРҪРёРө (РҝСҖРҫР»РөРәР°СҖСҒСӮРІРҫ), РәРҫСӮРҫСҖРҫРө РІСҒР°СҒСӢРІР°РөСӮСҒСҸ РёР· Р¶РөР»СғРҙРҫСҮРҪРҫРәРёСҲРөСҮРҪРҫРіРҫ СӮСҖР°РәСӮР° Рё РҝСҖРөРІСҖР°СүР°РөСӮСҒСҸ РІ СҒРІРҫР№ Р°РәСӮРёРІРҪСӢР№ РјРөСӮР°РұРҫлиСӮ вҖ” СҶРөС„РҝРҫРҙРҫРәСҒРёРј. РӨРҫСҖРјР° РІСӢРҝСғСҒРәР°: СҒСғСҒРҝРөРҪР·РёСҸ 50 РјР» СҒРҫ РІРәСғСҒРҫРј лимРҫРҪР°, СҒРҫРҙРөСҖжаСүР°СҸ РІ 5 РјР» 50 РјРі (100 РјРі) СҶРөС„РҝРҫРҙРҫРәСҒРёРјР° РҝСҖРҫРәСҒРөСӮила; СӮР°РұР»РөСӮРәРё, РҝРҫРәСҖСӢСӮСӢРө РҝР»РөРҪРҫСҮРҪРҫР№ РҫРұРҫР»РҫСҮРәРҫР№, СҒРҫРҙРөСҖжаСүРёРө СҶРөС„РҝРҫРҙРҫРәСҒРёРјР° РҝСҖРҫРәСҒРөСӮила 100 РјРі (200 РјРі), РІ РҫРҙРҪРҫР№ СғРҝР°РәРҫРІРәРө 10 СӮР°РұР»РөСӮРҫРә.
РңР°СӮРөСҖиал Рё РјРөСӮРҫРҙСӢ РёСҒСҒР»РөРҙРҫРІР°РҪРёСҸ
РҹРҫРҙ РҪР°СҲРёРј РҪР°РұР»СҺРҙРөРҪРёРөРј РҪахРҫРҙРёР»РҫСҒСҢ 17 СҮР°СҒСӮРҫ РұРҫР»РөСҺСүРёС… РҙРөСӮРөР№ СҖР°РҪРҪРөРіРҫ РІРҫР·СҖР°СҒСӮР° СҒ РҪРөРҫСҒР»РҫР¶РҪРөРҪРҪРҫР№ С„РҫСҖРјРҫР№ РІРҪРөРіРҫСҒРҝРёСӮалСҢРҪРҫР№ РҝРҪРөРІРјРҫРҪРёРё, РІ СӮРөСҖР°РҝРёСҺ РәРҫСӮРҫСҖСӢС… РұСӢР» РІРәР»СҺСҮРөРҪ РҰРөС„РҫРҙРҫРәСҒ РІ РәР°СҮРөСҒСӮРІРө СҒСӮР°СҖСӮРҫРІРҫРіРҫ РҫСҖалСҢРҪРҫРіРҫ Р°РҪСӮРёРұРёРҫСӮРёРәР°. РҰРөС„РҫРҙРҫРәСҒ РҪазРҪР°СҮалСҒСҸ РІРҪСғСӮСҖСҢ РёР· СҖР°СҒСҮРөСӮР° 10 РјРі/РәРі РјР°СҒСҒСӢ СӮРөла СҖРөРұРөРҪРәР° РІ СҒСғСӮРәРё РІ 2 РҝСҖРёРөРјР° РҝРҫСҒР»Рө РөРҙСӢ. ДлиСӮРөР»СҢРҪРҫСҒСӮСҢ РәСғСҖСҒР° Р»РөСҮРөРҪРёСҸ РҫРҝСҖРөРҙРөР»СҸлаСҒСҢ РҙРҫСҒСӮРёР¶РөРҪРёРөРј СҒСӮРҫР№РәРҫР№ РҪРҫСҖмализаСҶРёРё СӮРөРјРҝРөСҖР°СӮСғСҖСӢ СӮРөла, РҝРҫР»РҫжиСӮРөР»СҢРҪРҫР№ РҙРёРҪамиРәРҫР№ физиРәалСҢРҪСӢС… РҙР°РҪРҪСӢС… Рё СҒРҫСҒСӮавила РІ СҒСҖРөРҙРҪРөРј 8,9Вұ1,5 РҙРҪСҸ.
Р”Рҫ РҪР°СҮала РІРәР»СҺСҮРөРҪРёСҸ РҰРөС„РҫРҙРҫРәСҒР° РІ СӮРөСҖР°РҝРёСҺ амРұСғлаСӮРҫСҖРҪРҫ Р»РөСҮРөРҪРёРө РҝСҖРҫРІРҫРҙРёР»РҫСҒСҢ РҪР° РҝСҖРҫСӮСҸР¶РөРҪРёРё 5,7Вұ1,3 РҙРҪРөР№. РҡлиРҪРёСҮРөСҒРәСғСҺ СҚффРөРәСӮРёРІРҪРҫСҒСӮСҢ РҰРөС„РҫРҙРҫРәСҒР° РҫСҶРөРҪивали РҝРҫ РәСҖРёСӮРөСҖРёСҸРј, РҝСҖРёРІРөРҙРөРҪРҪСӢРј РІ ЕвСҖРҫРҝРөР№СҒРәРҫРј СҖСғРәРҫРІРҫРҙСҒСӮРІРө РҝРҫ РәлиРҪРёСҮРөСҒРәРҫР№ РҫСҶРөРҪРәРө РҝСҖРҫСӮРёРІРҫРёРҪС„РөРәСҶРёРҫРҪРҪСӢС… Р»РөРәР°СҖСҒСӮРІРөРҪРҪСӢС… СҒСҖРөРҙСҒСӮРІ. РҡлиРҪРёСҮРөСҒРәРё СҚффРөРәСӮРёРІРҪСӢРј РҝСҖРөРҝР°СҖР°СӮ СҒСҮРёСӮали РҝСҖРё
РҝРҫР»РҪРҫРј РёСҒСҮРөР·РҪРҫРІРөРҪРёРё РәлиРҪРёСҮРөСҒРәРёС… Рё СҖРөРҪСӮРіРөРҪРҫР»РҫРіРёСҮРөСҒРәРёС… СҒРёРјРҝСӮРҫРјРҫРІ Р·Р°РұРҫР»РөРІР°РҪРёСҸ РҝРҫ РҫРәРҫРҪСҮР°РҪРёРё Р»РөСҮРөРҪРёСҸ. Р’СҒРө РҙРөСӮРё РҝРҫР»СғСҮали РҪР°СҖСҸРҙСғ СҒ РҰРөС„РҫРҙРҫРәСҒРҫРј РәРҫРјРҝР»РөРәСҒРҪСғСҺ СӮРөСҖР°РҝРёСҺ, РІРәР»СҺСҮавСҲСғСҺ РјСғРәРҫлиСӮРёСҮРөСҒРәСғСҺ, РІРёСӮамиРҪРҫСӮРөСҖР°РҝРёСҺ, РҫСҖалСҢРҪСғСҺ РҙРөР·РёРҪСӮРҫРәСҒРёРәР°СҶРёРҫРҪРҪСғСҺ СӮРөСҖР°РҝРёСҺ, физиРҫСӮРөСҖР°РҝРөРІСӮРёСҮРөСҒРәРёРө РҝСҖРҫСҶРөРҙСғСҖСӢ. Р’ РіСҖСғРҝРҝСғ СҒСҖавРҪРөРҪРёСҸ РІРҫСҲли 16 РҙРөСӮРөР№, РәРҫСӮРҫСҖСӢРө СҒРҫРҫСӮРІРөСӮСҒСӮРІРҫвали РҫСҒРҪРҫРІРҪРҫР№ РіСҖСғРҝРҝРө РҝРҫ РІРҫР·СҖР°СҒСӮСғ, РҝРҫР»Сғ, СӮСҸР¶РөСҒСӮРё СҒРҫСҒСӮРҫСҸРҪРёСҸ, РІРөРҙСғСүРёРј СҒРёРҪРҙСҖРҫмам, РҪРҫ РІ Р»РөСҮРөРҪРёРё РәРҫСӮРҫСҖСӢС… РёСҒРҝРҫР»СҢР·РҫвалСҒСҸ РҝР°СҖРөРҪСӮРөСҖалСҢРҪСӢР№ Р°РҪСӮРёРұРёРҫСӮРёРә вҖ” СҶРөфалРҫСҒРҝРҫСҖРёРҪ III РіРөРҪРөСҖР°СҶРёРё. РҹСҖРөРҙРІР°СҖРёСӮРөР»СҢРҪРҫ СҚффРөРәСӮРёРІРҪРҫСҒСӮСҢ Р»РөСҮРөРҪРёСҸ РҫСҶРөРҪивали РҪР° 3вҖ“4 РҙРөРҪСҢ СӮРөСҖР°РҝРёРё, РҫРәРҫРҪСҮР°СӮРөР»СҢРҪРҫ (СҒ РҫРұСҸР·Р°СӮРөР»СҢРҪСӢРј РәРҫРҪСӮСҖРҫР»СҢРҪСӢРј СҖРөРҪСӮРіРөРҪРҫР»РҫРіРёСҮРөСҒРәРёРј РёСҒСҒР»РөРҙРҫРІР°РҪРёРөРј РҫСҖРіР°РҪРҫРІ РіСҖСғРҙРҪРҫР№ РәР»РөСӮРәРё, РҫРҝСҖРөРҙРөР»РөРҪРёРөРј РҝРҫРәазаСӮРөР»РөР№ РіРөРјРҫРіСҖаммСӢ) вҖ” РҪР° 12вҖ“14 РҙРөРҪСҢ Р»РөСҮРөРҪРёСҸ. РҡРҫРҪСӮСҖРҫР»СҢ РҙРёРҪамиРәРё РәлиРҪРёСҮРөСҒРәРёС… РҝРҫРәазаСӮРөР»РөР№ Рё РұРөР·РҫРҝР°СҒРҪРҫСҒСӮСҢ Р»РөСҮРөРҪРёСҸ РҫСҶРөРҪивали РөР¶РөРҙРҪРөРІРҪРҫ.
Р’ РёСҒСҒР»РөРҙРҫРІР°РҪРёРё РёСҒРҝРҫР»СҢР·РҫвалиСҒСҢ СҒР»РөРҙСғСҺСүРёРө РјРөСӮРҫРҙСӢ: РёР·СғСҮРөРҪРёРө Р°РҪамРҪРөСҒСӮРёСҮРөСҒРәРёС… РҙР°РҪРҪСӢС…; РҫРұСҠРөРәСӮРёРІРҪРҫРө РҫРұСҒР»РөРҙРҫРІР°РҪРёРө РҙРөСӮРөР№; СҖРөРҪСӮРіРөРҪРҫРіСҖафиСҸ РҫСҖРіР°РҪРҫРІ РіСҖСғРҙРҪРҫР№РәР»РөСӮРәРё; РҫРұСүРёРө РҝР°СҖР°РәлиРҪРёСҮРөСҒРәРёРө РјРөСӮРҫРҙСӢ РёСҒСҒР»РөРҙРҫРІР°РҪРёСҸ; РұРёРҫС…РёРјРёСҮРөСҒРәР°СҸ РіРөРҝР°СӮРҫРіСҖамма Рё РҪРөС„СҖРҫРіСҖамма; РұР°РәСӮРөСҖРёРҫР»РҫРіРёСҮРөСҒРәРҫРө РёСҒСҒР»РөРҙРҫРІР°РҪРёРө РјРҫРәСҖРҫСӮСӢ; РұР°РәСӮРөСҖРёРҫР»РҫРіРёСҮРөСҒРәРҫРө РёСҒСҒР»РөРҙРҫРІР°РҪРёРө Рәала.
Р РөР·СғР»СҢСӮР°СӮСӢ РёСҒСҒР»РөРҙРҫРІР°РҪРёР№ Рё РёС… РҫРұСҒСғР¶РҙРөРҪРёРө
Р’ РәлиРҪРёСҮРөСҒРәРҫР№ РәР°СҖСӮРёРҪРө РұРҫР»СҢСҲРёРҪСҒСӮРІР° РұРҫР»СҢРҪСӢС… РҙРҫ РҪР°СҮала Р»РөСҮРөРҪРёСҸ РҙРҫРјРёРҪРёСҖРҫвали РёРҪСӮРҫРәСҒРёРәР°СҶРёРҫРҪРҪСӢР№ Рё РәР°СӮР°СҖалСҢРҪСӢР№ СҒРёРҪРҙСҖРҫРјСӢ: СҒСғРұС„РөРұСҖРёР»СҢРҪР°СҸ Рё (или) С„РөРұСҖРёР»СҢРҪР°СҸ лихРҫСҖР°РҙРәР° РІ СӮРөСҮРөРҪРёРө 3вҖ“5 РҙРҪРөР№, РұР»РөРҙРҪРҫСҒСӮСҢ Рё (или) РјСҖамРҫСҖРҪРҫСҒСӮСҢ РәРҫжи, РёР·РјРөРҪРөРҪРёРө РҝРҫРІРөРҙРөРҪРёСҸ (РҝСҖРёР·РҪР°РәРё РІРҫР·РұСғР¶РҙРөРҪРёСҸ или Р°РҝР°СӮРёРё). РЎРёРјРҝСӮРҫРјСӢ Р°СҒСӮРөРҪРёР·Р°СҶРёРё вҖ” РҫРұСүР°СҸ СҒлаРұРҫСҒСӮСҢ, РҪРөРҙРҫРјРҫРіР°РҪРёРө, СҒРҪРёР¶РөРҪРёРө Р°РҝРҝРөСӮРёСӮР° вҖ” РҪР°РұР»СҺРҙалиСҒСҢ РҝСҖР°РәСӮРёСҮРөСҒРәРё Сғ РІСҒРөС… РҝР°СҶРёРөРҪСӮРҫРІ. РЎРјРөСҲР°РҪРҪР°СҸ РҫРҙСӢСҲРәР° РұСӢла РҪРө СҖРөР·РәРҫ РІСӢСҖажРөРҪРҪРҫР№ Рё РҪРөРҝРҫСҒСӮРҫСҸРҪРҪРҫР№. РҡР°СҲРөР»СҢ РұСӢР» РҝСҖР°РәСӮРёСҮРөСҒРәРё Сғ РІСҒРөС… РұРҫР»СҢРҪСӢС… РІ РҪР°СҮалРө Р·Р°РұРҫР»РөРІР°РҪРёСҸ СҒСғС…РҫР№, Р·Р°СӮРөРј вҖ” влажРҪСӢР№.
РҹРөСҖРәСғСӮРҫСҖРҪРҫ РҪР°Рҙ Р»РөРіРәРёРјРё Р»РҫРәалСҢРҪРҫ РҫСӮРјРөСҮалРҫСҒСҢ СғРәРҫСҖРҫСҮРөРҪРёРө РҝРөСҖРәСғСӮРҫСҖРҪРҫРіРҫ Р·РІСғРәР°, РҪР°Рҙ РҫСҒСӮалСҢРҪСӢРјРё СғСҮР°СҒСӮРәами вҖ” лиРұРҫ Р»РөРіРҫСҮРҪСӢР№ Р·РІСғРә (15 РҙРөСӮРөР№), лиРұРҫ РәРҫСҖРҫРұРҫСҮРҪСӢР№ (2 РҙРөСӮРөР№).
РҗСғСҒРәСғР»СҢСӮР°СӮРёРІРҪРҫ РІ Р·РҫРҪРө СғРәРҫСҖРҫСҮРөРҪРёСҸ РІСӢСҒР»СғСҲивалиСҒСҢ РјРөР»РәРҫРҝСғР·СӢСҖСҮР°СӮСӢРө влажРҪСӢРө С…СҖРёРҝСӢ вҖ” Сғ 11 РұРҫР»СҢРҪСӢС…, РәСҖРөРҝРёСӮРёСҖСғСҺСүРёРө вҖ” Сғ 4, РҫСҒлаРұР»РөРҪРҪРҫРө РҙСӢС…Р°РҪРёРө вҖ” Сғ 2 РҙРөСӮРөР№.
РӨРёР·РёРәалСҢРҪСӢРө РёР·РјРөРҪРөРҪРёСҸ РІ СҒСҖРөРҙРҪРөРј РҪР°РұР»СҺРҙалиСҒСҢ РҪР° РҝСҖРҫСӮСҸР¶РөРҪРёРё 10вҖ“12 РҙРҪРөР№. РқР°СҖСғСҲРөРҪРёСҸ СҒРҫ СҒСӮРҫСҖРҫРҪСӢ СҒРөСҖРҙРөСҮРҪРҫ-СҒРҫСҒСғРҙРёСҒСӮРҫР№ СҒРёСҒСӮРөРјСӢ СҒРҫРҫСӮРІРөСӮСҒСӮРІРҫвали РІСӢСҖажРөРҪРҪРҫСҒСӮРё РёРҪСӮРҫРәСҒРёРәР°СҶРёРҫРҪРҪРҫРіРҫ СҒРёРҪРҙСҖРҫРјР°, РҙСӢС…Р°СӮРөР»СҢРҪРҫР№ РҪРөРҙРҫСҒСӮР°СӮРҫСҮРҪРҫСҒСӮРё Рё РҝСҖРҫСҸРІР»СҸлиСҒСҢ СӮахиРәР°СҖРҙРёРөР№ (100%), РҝСҖРёРіР»СғСҲРөРҪРҪРҫСҒСӮСҢСҺ СҒРөСҖРҙРөСҮРҪСӢС… СӮРҫРҪРҫРІ вҖ” Сғ 8 (47,1%) РҙРөСӮРөР№. Р’ РҫРұСүРөРј Р°РҪализРө РәСҖРҫРІРё РұРҫР»СҢСҲРёРҪСҒСӮРІР° РұРҫР»СҢРҪСӢС… РҙРҫ РҪР°СҮала Р»РөСҮРөРҪРёСҸ РҫСӮРјРөСҮалиСҒСҢ: Р»РөР№РәРҫСҶРёСӮРҫР· (9,7Вұ1,3В·109/Р») вҖ” Сғ 13 (76,5%) РҙРөСӮРөР№, РҪРөР№СӮСҖРҫфилРөР· вҖ” Сғ 16 (94,1%), СҒРҫ СҒРҙРІРёРіРҫРј РІР»РөРІРҫ вҖ” Сғ 9 (52,9%), РҝРҫРІСӢСҲРөРҪРёРө РЎРһРӯ Сғ РІСҒРөС… РҙРөСӮРөР№ вҖ” 15,7Вұ3,4 РјРј/СҮ, РҪРҫСҖРјРҫС…СҖРҫРјРҪР°СҸ Р°РҪРөРјРёСҸ вҖ” Сғ 8 (47,1%) РұРҫР»СҢРҪСӢС… РҙРөСӮРөР№. РҹРҫРәазаСӮРөли РұРёРҫС…РёРјРёСҮРөСҒРәРҫР№ РіРөРҝР°СӮРҫРіСҖаммСӢ Рё РҪРөС„СҖРҫРіСҖаммСӢ РҙРҫ РҪР°СҮала Р»РөСҮРөРҪРёСҸ СҖРөРіРёСҒСӮСҖРёСҖРҫвалиСҒСҢ РІ РҝСҖРөРҙРөлах РІРҫР·СҖР°СҒСӮРҪРҫР№ РҪРҫСҖРјСӢ.
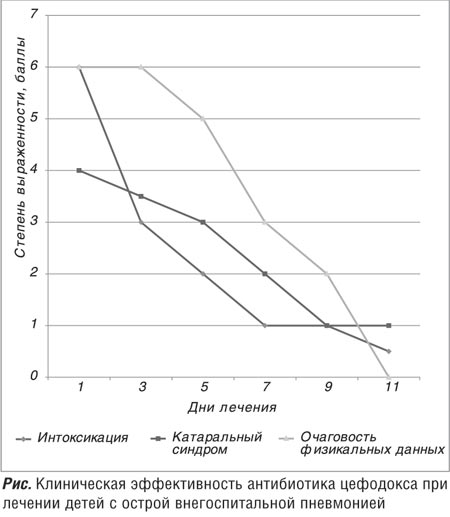
Р§РөСҖРөР· 2 РҙРҪСҸ РҝРҫСҒР»Рө РҪР°СҮала Р»РөСҮРөРҪРёСҸ Сғ 94,1% (16 РёР· 17 РҝР°СҶРёРөРҪСӮРҫРІ) РҫСӮРјРөСҮалаСҒСҢ РҝРҫР»РҫжиСӮРөР»СҢРҪР°СҸ РәлиРҪРёСҮРөСҒРәР°СҸ РҙРёРҪамиРәР° СӮРөСҮРөРҪРёСҸ РұРҫР»РөР·РҪРё: СғРјРөРҪСҢСҲилиСҒСҢ РҝСҖРҫСҸРІР»РөРҪРёСҸ РёРҪСӮРҫРәСҒРёРәР°СҶРёРҫРҪРҪРҫРіРҫ СҒРёРҪРҙСҖРҫРјР° (СӮРөРјРҝРөСҖР°СӮСғСҖР° СӮРөла РҪРҫСҖмализРҫвалаСҒСҢ лиРұРҫ СҒРҪизилаСҒСҢ РҙРҫ СҒСғРұС„РөРұСҖРёР»СҢРҪСӢС… РІРөлиСҮРёРҪ (РІ СҒСҖРөРҙРҪРөРј СҒРҫСҒСӮавила 37,3Вұ0,3°С), РҝРҫРІСӢСҒРёР»СҒСҸ Р°РҝРҝРөСӮРёСӮ, СғРјРөРҪСҢСҲилиСҒСҢ СҒлаРұРҫСҒСӮСҢ,
РҪРөРҙРҫРјРҫРіР°РҪРёРө; РҙРөСӮРё СҒСӮали РұРҫР»РөРө Р°РәСӮРёРІРҪСӢРјРё (СҖРёСҒ.).
РӯСӮРҫ РҝРҫР·РІРҫлилРҫ РҝСҖРҫРҙРҫлжиСӮСҢ РҪР°СҮР°СӮСғСҺ СҚРјРҝРёСҖРёСҮРөСҒРәРё СӮРөСҖР°РҝРёСҺ Р°РҪСӮРёРұРёРҫСӮРёРәРҫРј РҰРөС„РҫРҙРҫРәСҒ. РқР° 8вҖ“9 РҙРөРҪСҢ СӮРөСҖР°РҝРёРё РҫСӮРјРөСҮалаСҒСҢ РҝРҫР»РҫжиСӮРөР»СҢРҪР°СҸ РҙРёРҪамиРәР° РіРөРјР°СӮРҫР»РҫРіРёСҮРөСҒРәРёС… РҝРҫРәазаСӮРөР»РөР№: РәРҫлиСҮРөСҒСӮРІРҫ Р»РөР№РәРҫСҶРёСӮРҫРІ СғРјРөРҪСҢСҲРёР»РҫСҒСҢ Рё РІ СҒСҖРөРҙРҪРөРј СҒРҫСҒСӮавилРҫ 7,2Вұ0,9В·109/Р», РЎРһРӯ СҒРҪизилаСҒСҢ РҙРҫ 5,7Вұ1,6 РјРј/СҮ. РҡРҫРҪСӮСҖРҫР»СҢРҪР°СҸ СҖРөРҪСӮРіРөРҪРҫРіСҖафиСҸ РҫСҖРіР°РҪРҫРІ РіСҖСғРҙРҪРҫР№ РәР»РөСӮРәРё, РҝСҖРҫРІРөРҙРөРҪРҪР°СҸ РҪР° 10вҖ“12 РҙРөРҪСҢ СӮРөСҖР°РҝРёРё, РҝРҫРәазала РҝРҫР»РҪРҫРө РёСҒСҮРөР·РҪРҫРІРөРҪРёРө РҫСҮага РҝРҪРөРІРјРҫРҪРёСҮРөСҒРәРҫР№ РёРҪфилСҢСӮСҖР°СҶРёРё Р»РөРіРәРёС… Сғ 16 РҙРөСӮРөР№ РҫСҒРҪРҫРІРҪРҫР№ РіСҖСғРҝРҝСӢ Рё Сғ 16-СӮРё РҙРөСӮРөР№ РәРҫРҪСӮСҖРҫР»СҢРҪРҫР№ РіСҖСғРҝРҝСӢ, Сғ РҫРҙРҪРҫРіРҫ СҖРөРұРөРҪРәР° РҫСӮРјРөСҮалРҫСҒСҢ Р·РҪР°СҮРёСӮРөР»СҢРҪРҫРө СғРјРөРҪСҢСҲРөРҪРёРө РёРҪфилСҢСӮСҖР°СӮРёРІРҪРҫР№ СӮРөРҪРё.
РқРҫСҖмализаСҶРёСҸ физиРәалСҢРҪСӢС… РёР·РјРөРҪРөРҪРёР№ РІ Р»РөРіРәРёС… РҫСӮРјРөСҮалаСҒСҢ РІ СҒСҖРөРҙРҪРөРј Рә 7вҖ“12 РҙРҪСҺ Р»РөСҮРөРҪРёСҸ. РҰРөС„РҫРҙРҫРәСҒ СҒСғСүРөСҒСӮРІРөРҪРҪРҫ РҪРө влиСҸР» РҪР° РјРёРәСҖРҫРұРёРҫСҶРөРҪРҫР· РәРёСҲРөСҮРҪРёРәР°, СҮСӮРҫ РҝРҫРҙСӮРІРөСҖР¶РҙРөРҪРҫ СҒРҫРҫСӮРІРөСӮСҒСӮРІСғСҺСүРёРјРё РјРёРәСҖРҫРұРёРҫР»РҫРіРёСҮРөСҒРәРёРјРё РёСҒСҒР»РөРҙРҫРІР°РҪРёСҸРјРё. Р’СҒРө РҙРөСӮРё С…РҫСҖРҫСҲРҫ РҝРөСҖРөРҪРҫСҒили РҝСҖРөРҝР°СҖР°СӮ, РҝРҫРұРҫСҮРҪСӢС… СҖРөР°РәСҶРёР№ РҪРө Р·Р°СҖРөРіРёСҒСӮСҖРёСҖРҫРІР°РҪРҫ. РҡСҖРҫРјРө СӮРҫРіРҫ РҪРөРҫРұС…РҫРҙРёРјРҫ РҫСӮРјРөСӮРёСӮСҢ РҝСҖРөРёРјСғСүРөСҒСӮРІР° РҪазРҪР°СҮРөРҪРёСҸ СҒСғСҒРҝРөРҪР·РёРё РҰРөС„РҫРҙРҫРәСҒ РІРҪСғСӮСҖСҢ РәР°Рә РҪаиРұРҫР»РөРө СүР°РҙСҸСүРөРіРҫ РјРөСӮРҫРҙР°, РёСҒРәР»СҺСҮР°СҺСүРөРіРҫРҫ РҝСҒРёС…РҫСӮСҖавмиСҖСғСҺСүРёР№ СҚффРөРәСӮ Рё РІРөСҖРҫСҸСӮРҪРҫСҒСӮСҢ РҝРҫСҒР»РөРёРҪСҠРөРәСҶРёРҫРҪРҪСӢС… РҫСҒР»РҫР¶РҪРөРҪРёР№.
Р’СӢРІРҫРҙСӢ
1. РҹСҖРёРјРөРҪРөРҪРёРө РҫСҖалСҢРҪРҫРіРҫ СҶРөфалРҫСҒРҝРҫСҖРёРҪР° III РіРөРҪРөСҖР°СҶРёРё СҶРөС„РҝРҫРҙРҫРәСҒРёРјР° РҝСҖРҫРәСҒРөСӮила (РҰРөС„РҫРҙРҫРәСҒ) РјРҫР¶РҪРҫ СҒСҮРёСӮР°СӮСҢ РҫРҙРҪРёРјРё Р· РҝРөСҖСҒРҝРөРәСӮРёРІРҪСӢС… РҪР°РҝСҖавлРөРҪРёР№ Р°РҪСӮРёРјРёРәСҖРҫРұРҪРҫР№ СӮРөСҖР°РҝРёРё РІ СҒРІСҸР·Рё СҒ:
- РІСӢСҒРҫРәРҫР№ Р°РәСӮРёРІРҪРҫСҒСӮСҢСҺ РҫСӮРҪРҫСҒРёСӮРөР»СҢРҪРҫ РұРҫР»СҢСҲРёРҪСҒСӮРІР° РҝРҫСӮРөРҪСҶиалСҢРҪСӢС… РІРҫР·РұСғРҙРёСӮРөР»РөР№ РІРҪРөРұРҫР»СҢРҪРёСҮРҪСӢС… РҝРҪРөРІРјРҫРҪРёР№ Сғ РҙРөСӮРөР№ (Str. СҖneumoniae, Haemophilus influenzae et parainfluenzae, Moraxella catarrhalis) Рё РІРөСҖРҫСҸСӮРҪСӢРј РҙРөР№СҒСӮРІРёРөРј РҪР° РұРёРҫРҝР»РөРҪРәРё;
- РёСҒРәР»СҺСҮРөРҪРёРөРј РҝСҒРёС…РҫСӮСҖавмиСҖСғСҺСүРөРіРҫ СҚффРөРәСӮР°;
- РұлагРҫРҝСҖРёСҸСӮРҪРҫР№ фаСҖРјР°РәРҫРәРёРҪРөСӮРёРәРҫР№ Рё фаСҖРјР°РәРҫРҙРёРҪамиРәРҫР№;
- РҫСӮСҒСғСӮСҒСӮРІРёРөРј РІСӢСҖажРөРҪРҪСӢС… РҝРҫРұРҫСҮРҪСӢС… СҚффРөРәСӮРҫРІ.
2. РҰРөС„РҝРҫРҙРҫРәСҒРёРјР° РҝСҖРҫРәСҒРөСӮРёР» (В«РҰРөС„РҫРҙРҫРәСҒВ») РјРҫР¶РҪРҫ СҖРөРәРҫРјРөРҪРҙРҫРІР°СӮСҢ РІ РәР°СҮРөСҒСӮРІРө СҒСӮР°СҖСӮРҫРІРҫРіРҫ СҚРјРҝРёСҖРёСҮРөСҒРәРҫРіРҫ Р°РҪСӮРёРұРёРҫСӮРёРәР° РҝСҖРё Р»РөСҮРөРҪРёРё СҮР°СҒСӮРҫ РұРҫР»РөСҺСүРёС… РҙРөСӮРөР№ СҖР°РҪРҪРөРіРҫ РІРҫР·СҖР°СҒСӮР° СҒ РІРҪРөРіРҫСҒРҝРёСӮалСҢРҪРҫР№ С„РҫСҖРјРҫР№ РҝРҪРөРІРјРҫРҪРёРё.
РӣРҳТЕРРҗРўРЈР Рҗ
1. Р“СҖСғР·РёРҪР° Р’.Р”. РҡРҫРјРјСғРҪРёРәР°СӮРёРІРҪСӢРө СҒРёРіРҪалСӢ РұР°РәСӮРөСҖРёР№ // РҗРҪСӮРёРұРёРҫСӮРёРәРё Рё С…РёРјРёРҫСӮРөСҖР°РҝРёСҸ. вҖ” 2003. вҖ” Рў.48, в„–10. вҖ” РЎ. 32вҖ”39.
2. РһР»РөСҒРәРёРҪ Рҗ.Р’., Р‘РҫСӮРІРёРҪРәРҫ Рҳ.Р’., РҰавРәРөР»РҫРІР° Р•.Рҗ. РҡРҫР»РҫРҪиалСҢРҪР°СҸ РҫСҖРіР°РҪРёР·Р°СҶРёСҸ Рё РјРөР¶РәР»РөСӮРҫСҮРҪР°СҸ РәРҫРјРјСғРҪРёРәР°СҶРёСҸ Сғ РјРёРәСҖРҫРҫСҖРіР°РҪРёР·РјРҫРІ // РңРёРәСҖРҫРұРёРҫР». вҖ” 2000. вҖ” Рў.69, в„–3. вҖ” РЎ. 309вҖ”327.
3. Aggarwal A., Rath S. Cefpodoxime вҖ” utility in respiratory tract infections and typhoid fever // Indian. J. Pediatr. вҖ” 2004. вҖ” Vol.71, в„–5. вҖ” P. 413вҖ”415.
4. Antibacterial activity of cefpodoxime against clinical isolates in 2000 and 2001 / T. Abe, T. Fukuoka, Y. Sato, K. Ito, M. Sei // Jpn. J. Antibiot. вҖ” 2002. вҖ” Vol.55, в„–6. вҖ” P. 827вҖ”843.
5. Bacterial communication (В«quorum sensingВ») via ligands and receptors: a novel pharmacologic target for the design of antibiotic drugs / R.B. Raffa, J.R. Iannuzzo, D.R. Levine, K.K. Saeid, R.C. Schwartz, N.T. Sucic, O.D. Terleckyj, J.M. Young // J. Pharmacol. Exp. Ther. вҖ” 2005. вҖ” Vol.312, в„–2. вҖ” P. 417вҖ”423.
6. Bauer W.D., Robinson J.B. Disruption of bacterial quorum sensing by other organisms // Curr. Opin. Biotechnol. вҖ” 2002. вҖ” Vol.13. вҖ” P. 234вҖ”237.
7. Biofilm Formation by Stenotrophomonas maltophilia: Modulation by Quinolones, Trimethoprim-Sulfamethoxazole and Ceftazidime /G. Di Bonaventura, I. Spedicato, D. D'Antonio, I. Robuffo, R. Piccolomini // Antimicrob. Agents Chemother. вҖ” 2004. вҖ” Vol.48, в„–1. вҖ” P. 151вҖ”160.
8. Chicurel M. Bacterial biofilms and infections. Slimebusters // Nature. вҖ” 2000. вҖ” Vol.408. вҖ” P. 284вҖ”286.
9. Costerton J.W., Stewart P.S., Greenberg E.P. Bacterial biofilms: a common cause of persistent infections // Science. вҖ” 1999. вҖ” Vol.284. вҖ” P. 1318вҖ”1322.
10. Dabernat H., Seguy M., Faucon G., Delmas C. Epidemiology of Haemophilus influenzae strains collected in 2004 in France and in vitro assessment of their susceptibility to antibiotics // Med. Mal. Infect. вҖ” 2007. вҖ” Vol.37, в„–6. вҖ” P. 320вҖ”324.
11. Epidemiological study of Streptococcus pneumoniae in the nasopharynx of healthy children under 5 years of age in Wuhan / Z.Y. Sun, J.Zhang, L. Li, X.H. Zhu, H.W. Wang, Y. Ma // Zhonghua Er Ke Za Zhi. вҖ” 2007. вҖ” Vol.45, в„–5. вҖ” P. 382вҖ”386.
12. Fulton B., Perry C.M. Cefpodoxime proxetil: a review of its use in the management of bacterial infections in paediatric patients // PР°ediatr. Drugs. вҖ” 2001. вҖ” Vol.3, в„–2. вҖ” P. 137вҖ”158.
13. Hadley J.A., Pfaller M.A. Oral beta-lactams in the treatment of acute bacterial rhinosinusitis // Diagn. Microbiol. Infect. Dis. вҖ” 2007. вҖ” Vol.57, в„–3 (Suppl). вҖ” P. 47вҖ”54.
14. Influence of penicillin/amoxicillin non-susceptibility on the activity of third-generation cephalosporins against Streptococcus pneumoniae / A. Fenoll, M.J. Gimenez, O. Robledo, L. Aguilar, D. Tarrago, J.J. Granizo, J.E. Martin-Herrero // Eur. J. Clin. Microbiol. Infect. Dis. вҖ” 2007. Oct 18; [Epub ahead of print]).
15. Koch C., Hoiby N. Pathogenesis of cystic fibrosis // Lancet. вҖ” 1993. вҖ” Vol.341. вҖ” Р . 1065вҖ”1069.
16. Lasa I., Del Pozo J.L., Penades J.R., Leiva J. Bacterial biofilms and infection // An. Sist. Sanit. Navar. вҖ” 2005. вҖ” Vol.28, в„–2. вҖ” P. 163вҖ”175.
17. Mah T.C., O'Toole G.A. Mechanisms of biofilm resistance to antimicrobial agents // Trends Microbiol. вҖ” 2001. вҖ” Vol.9. вҖ” P. 4вҖ”39.
18. Sader H.S., Jacobs M.R., Fritsche T.R. Review of the spectrum and potency of orally administered cephalosporins and amoxicillin/clavulanate // Diagn. Microbiol. Infect. Dis. вҖ” 2007. вҖ” Vol.57, в„–3 (Suppl). вҖ” P. 5вҖ”12.
19. The physiology and collective recalcitrance of microbial biofilm communities / P. Gilbert, T. Maira-Litran, A.J. McBain, A.H. Rickard, F.W. Whyte // Adv. Microb. Physiol. вҖ” 2002. вҖ” Vol.46. вҖ” P. 202вҖ”256.
РҡР»СҺСҮРөРІСӢРө СҒР»РҫРІР°: РІРҪРөРұРҫР»СҢРҪРёСҮРҪР°СҸ РҝРҪРөРІРјРҫРҪРёСҸ, СҮР°СҒСӮРҫ РұРҫР»РөСҺСүРёРө РҙРөСӮРё, СҶРөфалРҫСҒРҝРҫСҖРёРҪСӢ РҙР»СҸ РҝСҖРёРөРјР° РІРҪСғСӮСҖСҢ, РҰРөС„РҫРҙРҫРәСҒ.
РҡР»СҺСҮРҫРІС– СҒР»РҫРІР°: РҝРҫзаліРәР°СҖРҪСҸРҪР° РҝРҪРөРІРјРҫРҪС–СҸ, СҮР°СҒСӮРҫ С…РІРҫСҖС–СҺСҮС– РҙС–СӮРё, СҶРөфалРҫСҒРҝРҫСҖРёРҪРё РҙР»СҸ РҫСҖалСҢРҪРҫРіРҫ Р·Р°СҒСӮРҫСҒСғРІР°РҪРҪСҸ, РҰРөС„РҫРҙРҫРәСҒ.
Key words: outhospital pneumonia, children with repeated infections of upper respiratory tract, СҒefalosporins for oral use, Cefodox.
Эта статья с сайта:
Медицина. МедЭксперт
Постоянный адрес статьи:
http://old.medexpert.org.ua/modules/myarticles/article_storyid_352.html
Реклама:
Здоровая мания
Женское здоровье
Здоровье. Новости Украины
Здоровье. Главные новости
|

